Synthese und Reaktionen von Oxadiazolyl-Uretdionen
Symmetrisch oder unsymmetrisch substituierte Uretdione werden nach bekannten Verfahren aus Isocyanaten unter dem katalytischen Einfluss von Triäthylphosphin oder Pyridin hergestellt. Die in dieser Arbeit beschriebenen Methoden haben dagegen den Vorteil, dass von einem Amin und einem leicht zugänglichen Isocyanat ausgegangen wird und damit auch Substituenten an den Uretdionring gebracht werden können, deren Isocyanate nicht oder nur sehr schlecht hergestellt werden können.
Oxadiazolyl-uretdione sind bisher unbekannte Verbindungen.
"Zur Kenntnis der kernsubstituierten 2-Amino-1,3,4-oxadiazole“ Dissertation,
Manfred Just, 1963, Universität Potsdam;
"Über die Einwirkung von Isocyanaten auf substituierte 2-Amino-1,3,4-oxadiazole",
Heinz Gehlen, Manfred Just, Ann. Chem. 151, 692 (1966);
"Recent Advances in 1,3,4-Oxadiazol Chemistry", A. Hetzheim, K. Möckel,
Adv. in Heterocyclc Chemistry, Vol 7, (1966)]
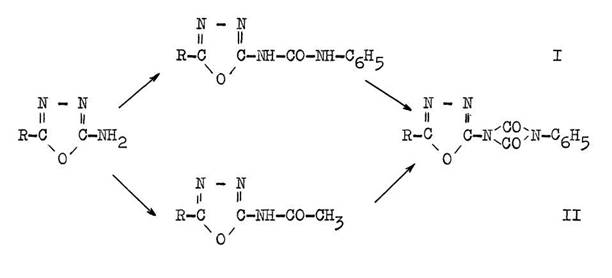
Der Weg über das Acetylaminooxadiazol (II) ist zweckmäßiger, da dabei nur 2 Mol Isocyanat pro Mol Amino-oxadiazol umgesetzt werden. Über den Oxadiazolyl-harnstoff (I) ist das Uretdion jedoch in einer Stufe aus dem Aminooxadiazol herstellbar, wenn man dieses mit etwas mehr als drei Mol Isocyanat zur Reaktion bringt.
Dass die gefundene Synthese von Uretdionen aus aromatischen Acetyl-aminen allgemein gültig ist, konnte an der Herstellung des Naphthyl-phenyl-uretdions aus ß-Acetylamino-naphthalin gezeigt werden.
Uretdione sind thermolabil. Bei stärkerem Erhitzen erfolgt eine Rückspaltung in die Isocyanate, die dann in bekannter Weise weiter reagieren können.
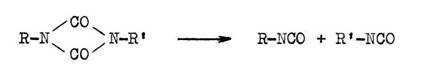
Unter verhältnismäßig milden Bedingungen erfolgt eine Anlagerung von Aminen oder Alkoholen. Dabei ist die Bildung von zwei Isomeren möglich :
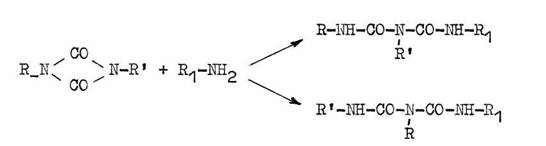
Oxadiazolyl-phenyl-uretdione liefern aber einheitliche, in den meisten Fällen quantitativ entstehende Reaktionsprodukte, bei denen sich der Oxadiazolring an der sekundären Amidgruppe befindet, während der Phenylrest am tertiären Stickstoffatom gebunden ist.
Die folgende Aufstellung gibt einen Überblick über die Reaktionsmöglichkeiten:
Umsetzungen der Oxadiazolyl-phenyl-uretdione
Reaktionspartner |
Reaktionsprodukt |
Anm.) |
R-NH2 |
Oxd-NH-CO-N(C6H5)-CO-NH-R |
Biurete |
Tab. 5 |
R-NH-R' |
Oxd-NH-CO-N(C6H5)-CO-N(R, R') |
Biurete |
Tab. 5 |
R-OH |
Oxd-NH-CO-N(C6H5)-CO-O-R |
Allophansäureester |
Tab. 6 |
C6H5-NH-NH2 |
Oxd-NH-CO-N(C6H5)-CO-NH-NH-(C6H5)
Oxd-NH-CO-NH-NH-(C6H5) |
Seite 43 |
C6H5-NH-CO-NH-NH2 |
Oxd-NH-CO-N(C6H5)-CO-NH-NH-CO-NH-(C6H5) |
Seite 43 |
H2N-CH2-CH2-NH2 |
Oxd-NH-CO-N(C6H5)-CO-NH-CH2-CH2-NH2
(Oxd-NH-CO-N(C6H5)-CO-NH-CH2-)2 |
Seite 44 |
H2N-CH2-CH2-OH |
Oxd-NH-CO-N(C6H5)-CO-NH-CH2-CH2-OH |
Seite 44 |
H2N-NH2 |
Oxd-NH-CO-N(C6H5)-CO-NH-NH2 |
Seite 45 |
Anm.) Die Angaben beziehen sich auf
„Zur Kenntnis der kernsubstituierten 2-Amino-1,3,4-oxadiazole“
Dissertation, Manfred Just (1963) Universität Potsdam


