"Zur Kenntnis der kernsubstituierten 2-Amino-1,3,4-oxadiazole", Seite 70, Dissertation A;
Manfred Just, (1963) Pädagogische Hochschule Potsdam
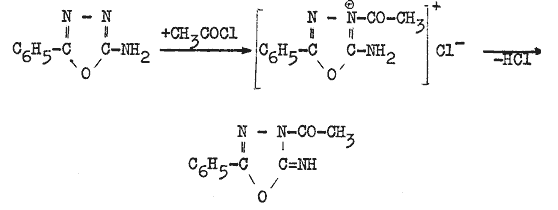
Ohne alkalische Zusätze und besonders bei Anwesenheit von starken Mineralsäuren wird bei der Acylierung die Acylgruppe an das Stickstoffatom 3 des Oxadiazolringes angelagert. Dabei bilden sich die Salze der 3-acylierten 2-Imino-5-aryl-1,3,4-oxadiazoline.

Das 2-Imino-3-acetyl-5-phenyl-1,3,4-oxadiazolin-hydrochlorid wird aus feingepulvertem 2-Amino-5-phenyl-1,3,4-oxadiazol durch Umsetzung mit überschüssigem Acetylchlorid hergestellt. Nach Waschen mit trockenem Diäthylether wird quantitativ die Zielsubstanz erhalten. Die Synthese in wasserfreiem Benzol gibt gleiche Ausbeuten.
Aus der Lösung des Hydrochlorids in Wasser fällt nach der Neutralisation mit 10%iger Kalilauge das 2-Imino-3-acetyl-5-phenyl-1,3,4-oxadiazolin aus.
Aliphatisch-substituierte Aminooxadiazole ergeben Reaktionsprodukte, die sich aus den primär entstehenden sehr unbeständigen Imino-acyl-oxadiazolinen bilden. Die Ähnlichkeit von Acylierung und Alkylierung berechtigt zu dieser
Annahme, da bei den Alkylierungsprodukten diese Sekundärreaktion eindeutig nachgewiesen wurde (siehe Dimere Imino-oxadiazoline, Reaktionen am Ring)
2-Imino-3-acetyl-5-phenyl-1,3,4-oxadiazolin
Schmelzpunkt: ab 115 °C
| Analyse | % C | % H | % N |
ber.: |
59,1 |
4,43 |
20,68 |
gef.: |
59,9 |
4,83 |
20,74 |
Die Substanz fluoresziert ähnlich wie das 2-Imino-3-alkyl-5-phenyl-1,3,4-oxadiazolin