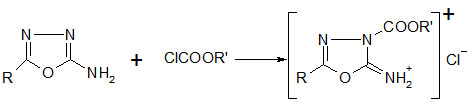
2-Imino-3-carbo(alkoxy,aryloxy)-5-phenyl-1,3,4-oxadiazolin.hydrochloride
"Zur Kenntnis der 2-Imino-1,3,4-oxadiazoline - Reaktionen mit Chlorameisensäureestern";
Ackermann, Roland; Dissertation (1983), Pädagogische Hochschule Erfurt/Mühlhausen
"Verfahren zur Herstellung von 5-substituierten 2-Imino-1,3,4-oxadiazolin-Derivaten",
Just, Manfred; Ackermann, Roland; DDR-WP C07D 245 196 29.04.1987
2-Amino-1,3,4-oxadiazole reagieren mit Chlorameisensäureestern in sehr guten Ausbeuten zu den entsprechenden Salzen der 2-Imino-1,3,4-oxadiazoline:

Tabelle 1 zeigt die Derivate des 2-Amino-5-phenyl-1,3,4-oxadiazols,
Tabelle 2 die Daten verschiedener aromatisch-substituierter Aminooxadiazole
Tabelle 3 die Daten verschiedener aliphatisch-substituierter Aminooxadiazole
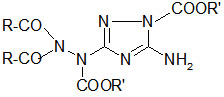 Bei einem Zusatz von Triethylamin bilden sich Reaktionsprodukte, die den dimeren Imino-oxadiazolinen entsprechen, deren Struktur durch Röntgenstrukturanalyse bestätigt wurde.
Bei einem Zusatz von Triethylamin bilden sich Reaktionsprodukte, die den dimeren Imino-oxadiazolinen entsprechen, deren Struktur durch Röntgenstrukturanalyse bestätigt wurde.
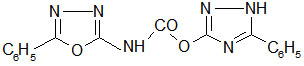 Aus 2-Amino-5-phenyl-1,3,4-oxadiazol wurde mit Chlorameisensäureethylester das gleiche Produkt erhalten, das sich auch beim Erhitzen des 2-Imino-3-carboethoxy-5-phenyl-1,3,4-oxadiazolin-hydrochlorids bildet.
Es ist das O-(3Phenyl-1,2,4-triazol5-yl)-N-(5-phenyl-1,3,4-oxadiazol-2-yl)-urethan.
Aus 2-Amino-5-phenyl-1,3,4-oxadiazol wurde mit Chlorameisensäureethylester das gleiche Produkt erhalten, das sich auch beim Erhitzen des 2-Imino-3-carboethoxy-5-phenyl-1,3,4-oxadiazolin-hydrochlorids bildet.
Es ist das O-(3Phenyl-1,2,4-triazol5-yl)-N-(5-phenyl-1,3,4-oxadiazol-2-yl)-urethan.
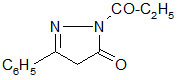 Die
freien Basen sind nicht zu isolieren. In Ammoniaklösung bildet sich das
Aminooxadiazol zurück. Aus der Umsetzung mit Kaliumhydrogencarbonat wurde das
3-Carboethoxy-5-phenyl-1,3,4-oxadiazolin-2-on isoliert.
Die
freien Basen sind nicht zu isolieren. In Ammoniaklösung bildet sich das
Aminooxadiazol zurück. Aus der Umsetzung mit Kaliumhydrogencarbonat wurde das
3-Carboethoxy-5-phenyl-1,3,4-oxadiazolin-2-on isoliert.
Über diesen Weg können elegant Oxadiazolinone phosgenfrei
hergestellt werden.
Die
Tabelle 4 zeigt einige Beispiele.
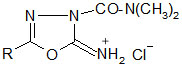 Die Reaktion mit Dimethylcarbamidsäurechlorid führt zu 2-Imino-3-dimethylcarbamido-5-(aryl,alkyl)-1,3,4-oxadiazolin-hydrochloriden (siehe Tabelle 5).
Die Reaktion mit Dimethylcarbamidsäurechlorid führt zu 2-Imino-3-dimethylcarbamido-5-(aryl,alkyl)-1,3,4-oxadiazolin-hydrochloriden (siehe Tabelle 5).