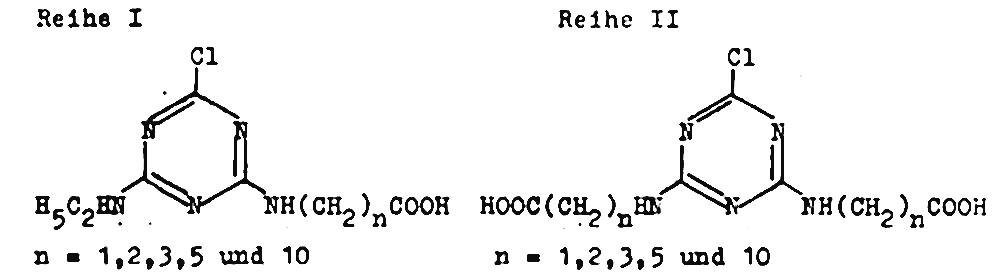zur Startseite
2-Chlor-4-äthylamino-6-carboxyalkylamino-s-triazine
"Zur Kenntnis einiger Carboxyalkylamino-s-triazine"
Dissertation (1976); Karl-Heinz Uhl; Pädagogische Hochschule Erfurt/Mühlhausen
Die Arbeiten zum s-Triazin-Thema hatten vertragsgemäß die Ziele:
-
die Literatur im Anschluss an die 1959 erschienene Monographie "s-Triazines and Derivatives" von
SMOLIK und RAPOPORT zu erfassen;
- neue,
patentrechtlich nicht gebundene Stoffgruppen zu erkennen und reproduzierbare
Synthesen dazu zu entwickeln;
- orientierende
Biotests durchzuführen;
- Substanzen für
breite Anwendungstests und zur Untersuchung von Struktur-Wirkungs-Beziehungen
zur Verfügung zu stellen, wobei das Cyanurchlorid die Basis sein sollte.
Über die herbizide Wirkung einiger
s-Triazinderivate, hat 1955 Gast
erstmals berichtet. Die Synthesen der 2-Chlor-4,6-di-(alkylamino)-s-triazine,
der 2-Chlor-4-alkylamino-6-(N,N-dialkylamino)-s-triazine und der
2-Chlor-4,6-di-(N,N-dialkylamino)-s-triazine, zu denen die Herbizide Simazin,
Ipazin und Chlorazin gehören, sind bereits von Hofmann (1885) und von
Diels (1899)
beschrieben worden. Eine Reihe von Substanzen dieser Verbindungsgruppen wurden auch von
Pearlman und Banks (1948) und von Thurston und Mitarbeitern (1951) synthetisiert.
Von Hofmann (1885) wurden auch die ersten Synthesen für die zu den oben genannten Chlor-s-triazinen analogen
Methoxy- und Methylthio-s-triazine beschrieben. Da sich die zu diesen Gruppen
zählenden Herbizide, wie Simeton, Atraton, Ametryn und Prometryn, ebenfalls
durch eine ausgezeichnete Wirksamkeit, vor allem aber durch eine wesentlich
bessere Löslichkeit gegenüber ihren Chloranalogen auszeichnen, sind in den
Jahren nach 1955 intensive Anstrengungen unternommen worden, um anlehnend an die
Struktur des klassischen Triazinherbizids - dem Simazin - neue wirksame
s-Triazinderivate zu synthetisieren.
Eine geschlossene Darstellung der Carboxyalkylamino-s-triazine wird mit dieser Arbeit gegeben.
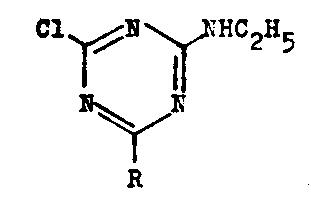 Die Herstellung des 2,4-Dichlor-6-äthylamino-s-triazins ist seit 1958
bekannt. Diese Verbindung ist die Basis für die Umsetzungen mit dem Natriumsalz
der Aminocarbonsäuren. Es erwies sich als günstiger, wenn die Synthese im
Eintopfverfahren aus Cyanurchlorid in Aceton durchgeführt wird. Die
Gesamtausbeute ist dadurch deutlich höher.
Die Herstellung des 2,4-Dichlor-6-äthylamino-s-triazins ist seit 1958
bekannt. Diese Verbindung ist die Basis für die Umsetzungen mit dem Natriumsalz
der Aminocarbonsäuren. Es erwies sich als günstiger, wenn die Synthese im
Eintopfverfahren aus Cyanurchlorid in Aceton durchgeführt wird. Die
Gesamtausbeute ist dadurch deutlich höher.
|
Nr. |
R |
Summenformel |
Molmasse |
F. (°C) |
Ausbeute |
Analyse C% H
% N % Cl % |
| I |
NHCH2COOH |
C7H10ClN5O2 |
231,50 |
ab 195° Zers. |
68 % |
ber. gef. |
36,28 36,07 |
4,32 4,52 |
30,23 30,65 |
15,31 15,65 |
| II |
NH(CH2)2COOH |
C8H12ClH5O2 |
245,51 |
178-180° |
64 % |
ber. gef. |
39,10 38,89 |
4,85 4,88 |
28,11 -- |
14,43 13,98 |
| III |
NH(CH2)3COOH |
C9H14ClN5O2 |
259,52 |
184-185° |
48 % |
ber. gef. |
41,56 41,72 |
5,39 5,62 |
26,96 27,30 |
13,65 14,09 |
| IV |
NH(CH2)5COOH |
C11H18ClH5O2 |
287,54 |
135,7° (Äthanol) |
49 % |
ber. gef. |
45,89 45,68 |
6,22 6,51 |
24,34 24,64 |
12,32 12,05 |
| V |
NH(CH2)10COOH |
C16H28ClN5O2 |
357,59 |
108-112° (Äthanol) |
71 % |
ber. gef. |
53,71 53,87 |
7,83 8,13 |
19,61 19,63 |
9,91 - |
2-Chlor-4,6-di-carboxyalkylamino-s-triazine
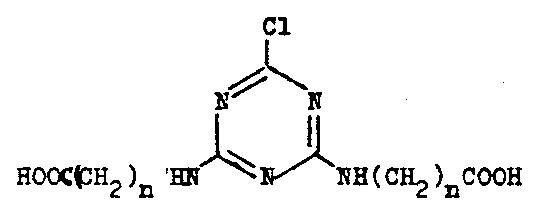 Ebenfalls in Aceton kann das Cyanurchlorid mit der entsprechenden Menge des
Aminosäuresalzes bei Temperatursteigerung von -10 °C auf 45 °C und etwa
2-stündigem Rühren zur Zielverbindung umgesetzt werden.
Ebenfalls in Aceton kann das Cyanurchlorid mit der entsprechenden Menge des
Aminosäuresalzes bei Temperatursteigerung von -10 °C auf 45 °C und etwa
2-stündigem Rühren zur Zielverbindung umgesetzt werden.
|
Nr. |
R |
Summenformel |
Molmasse |
Fp. (°C) |
Aus-beute |
Analyse C %
H % N %
Cl % |
|
VI |
NH(CH)2COOH |
C7H8ClN5O4 |
261,48 |
> 200° Zers. (Dioxan/H2O) |
63 % |
ber. gef. |
32,12 32,86 |
3,06 3,50 |
26,79
- |
13,55 13,81 |
|
VII |
NH(CH2)2COOH |
C9H12ClN5O4 |
289,50 |
165-167° |
59 % |
ber. gef. |
37,31 37,54 |
4,14 4,79 |
24,18 24,35 |
12,24 11,86 |
|
VIII |
NH(CH2)3COOH |
C11H16ClN5O4 |
317,52 |
167-169° (THF) |
51 % |
ber. gef. |
41,56 41,50 |
5,04 5,61 |
22,04 21,81 |
11,16 11,12 |
|
IX |
NH(CH2)5COOH |
C15H24ClN5O4 |
373,56 |
155-157° (THF) |
40 % |
ber. gef. |
48,02 48,48 |
6,42 7,02 |
18,73 18,27 |
9,48 9,52 |
|
X |
NH(CH2)10COOH |
C25H44ClN5O4 |
513,66 |
142-145° (THF) |
70 % |
ber. gef. |
58,25 58,69 |
8,35 8,47; |
13,62 13,53 |
6,88 6,85 |
2-Methylthio-4,6-di-carboxyalkylamino-s-triazin
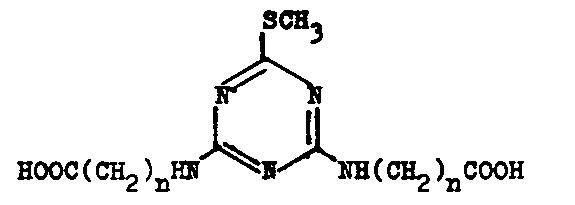 Die Reaktion wird in Aceton durchgeführt. Zunächst werden eine äquivalente Menge
Methylmercaptan und 5 N-Natronlauge eingerührt. Nach ein bis zwei Stunden
werden die Natriumsalzlösung der Aminocarbonsäure und Natronlauge zugegeben und
2 Stunden auf 60 °C erhitzt.
Die Reaktion wird in Aceton durchgeführt. Zunächst werden eine äquivalente Menge
Methylmercaptan und 5 N-Natronlauge eingerührt. Nach ein bis zwei Stunden
werden die Natriumsalzlösung der Aminocarbonsäure und Natronlauge zugegeben und
2 Stunden auf 60 °C erhitzt.
|
Nr. |
R |
Summenformel |
Molmasse |
Fp. (°C) |
Aus-beute |
Analyse C % H %
N % Cl % |
|
VI |
NH(CH)2COOH |
C7H8ClN5O4 |
261,48 |
ab 200° Zers.
(Dioxan/H2O) |
63 % |
ber.
gef. |
32,12
32,86 |
3,06
3,50 |
26,79
--- |
13,55
13,81 |
|
VII |
NH(CH2)2COOH |
C9H12ClN5O4 |
289,50 |
165-167° |
59
% |
ber.
gef. |
37,31
37,54 |
4,14
4,79 |
24,18
24,35 |
12,24
11,86 |
|
VIII |
NH(CH2)3COOH |
C11H16ClN5O4 |
317,52 |
167-169° (THF) |
51
% |
ber.
gef. |
41,56
41,50 |
5,04
5,61 |
22,04
21,81 |
11,16
11,12 |
|
IX |
NH(CH2)5COOH |
C15H24ClN5O4 |
373,56 |
155-157° (THF) |
40 % |
ber.
gef. |
48,02
48,48 |
6,42
7,02 |
18,73
18,27 |
9,48 9,52 |
|
XX |
NH(CH2)10COOH |
C25H44ClN5O4 |
513,66 |
142-145° (THF) |
70 % |
ber.
gef. |
58,25
58,69 |
8,35
8,47; |
13,62
13,53 |
6,88 6,85 |
2-Methylthio-4-äthylamino-6-carboxyalkylamino-s-triazin
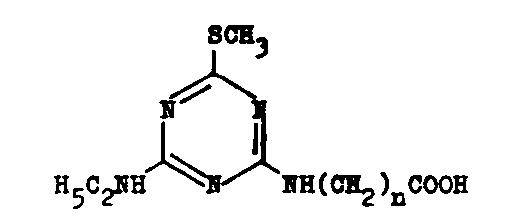 Ohne Isolierung des Zwischenproduktes wird Cyanurchlorid in Aceton zunächst
mit Methylmercaptan/Natronlauge, dann mit Äthylamin und danach mit dem
Natriumsalz der entsprechenden Aminosäure umgesetzt.
Ohne Isolierung des Zwischenproduktes wird Cyanurchlorid in Aceton zunächst
mit Methylmercaptan/Natronlauge, dann mit Äthylamin und danach mit dem
Natriumsalz der entsprechenden Aminosäure umgesetzt.
|
Nr.
|
R
|
Summenformel
|
Molmasse
|
F.
(°C)
|
Ausbeute
|
Analyse
C %
H %
N %
|
|
XI
|
NHCH2COOH
|
C8H13N5O2S |
243,12
|
225-228
(Ethanol)
|
71
%
|
ber.
gef.
|
39,50
40,06
|
5,35
6,10
|
28,80
28,58
|
|
XII
|
NH(CH2)2COOH
|
C5H15N5O2S
|
257,13
|
170-173 (Ethanol)
|
60
%
|
ber.
gef.
|
42,02
42,53
|
5,84
5,67
|
27,37
27,43
|
|
XIII
|
NH(CH2)3COOH
|
C10H17N5O2S
|
271,14
|
148-151
(Ethanol)
|
64
%
|
ber.
gef.
|
44,28
44,11
|
6,27
6,40
|
25,83
25,64
|
|
XIV
|
NH(CH2)5COOH
|
C12H21N5O2S
|
299,16
|
139-142
(Ethanol)
|
58
%
|
ber.
gef.
|
48,16
48,10
|
7,02
7,01
|
23,41
23,55
|
|
XV
|
NH(CH2)10COOH
|
C17H31N5O2S
|
369,21
|
65-69
|
42
%
|
ber.
gef.
|
55,28
54,96
|
8,40
8,75
|
18,97
19,41
|
2,4-Dichlor-6-methoxycarboalkylamino-s-triazine
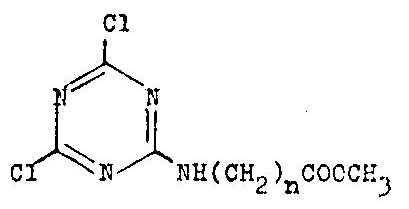 Verbindungen dieser Gruppe sind 1961 von Nestler
(Dissertation, TU Dresden) beschrieben worden.
Verbindungen dieser Gruppe sind 1961 von Nestler
(Dissertation, TU Dresden) beschrieben worden.
Die Tabelle zeigt die eigenen Syntheseergebnisse.
|
Nr.
|
n
|
Summenformel
|
Molmasse
|
Fp. °C
|
Ausbeute
|
Analyse Cl %
|
|
XXI
|
1
|
C6H6Cl2N4O2
|
236,94
|
138-140 (Benzol)
|
70 %
|
ber.
gef.
|
29,95
29,91
|
|
XXII
|
2
|
C7H8Cl2N4O2
|
250,95
|
83-84,5
(Benzol)
|
65 %
|
ber.
gef.
|
28,28
28,60
|
|
XXIII
|
3
|
C8H10CI2N4O2
|
264,96
|
102-103 (Benzol)
|
58 %
|
ber.
gef.
|
26,79
25,59
|
2,4-Dioxo-carboxyalkylamino-s-triazin
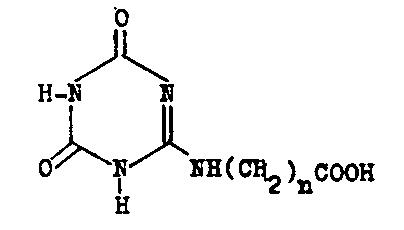 Die Herstellung dieser Verbindungen aus Cyanurchlorid
könnte über das zuerst gebildete Chlor-dioxo-triazin oder über das nicht
isolierbare Dichlor-carboxyalkylamino-triazin bei anschließender Hydrolyse
erfolgen. In jedem Fall verläuft aber die Hydrolyse zur Cyanursäure so schnell,
dass keine Zielverbindungen erhalten werden. Es ist sicher, dass die Carboxyl-Gruppe
die Hydrolyse katalysiert, denn der Einsatz von Derivaten der Aminosäuren, wie
Nitrile, Amide oder Ester, führt zu den entsprechenden Dioxo-Verbindungen. Die
Substanzen der folgenden Tabelle sind durch Hydrolyse der entsprechenden
Dichlor-methoxycarboalkylamino-triazinen erhalten worden.
Die Herstellung dieser Verbindungen aus Cyanurchlorid
könnte über das zuerst gebildete Chlor-dioxo-triazin oder über das nicht
isolierbare Dichlor-carboxyalkylamino-triazin bei anschließender Hydrolyse
erfolgen. In jedem Fall verläuft aber die Hydrolyse zur Cyanursäure so schnell,
dass keine Zielverbindungen erhalten werden. Es ist sicher, dass die Carboxyl-Gruppe
die Hydrolyse katalysiert, denn der Einsatz von Derivaten der Aminosäuren, wie
Nitrile, Amide oder Ester, führt zu den entsprechenden Dioxo-Verbindungen. Die
Substanzen der folgenden Tabelle sind durch Hydrolyse der entsprechenden
Dichlor-methoxycarboalkylamino-triazinen erhalten worden.
|
Nr. |
n |
Fp. (°C) |
Summenformel |
Molmasse |
Ausbeute |
Analyse
C % H % |
|
XXVI |
1 |
über 300 |
C5H6N4O4 |
186,01 |
69% |
ber. |
32,08 |
3,74 |
|
gef. |
31,93 |
4,03 |
|
XXVII |
2 |
ab 262 Zers. |
C6H8N4O4 |
200,02 |
56% |
ber. |
36,03 |
4,00 |
|
gef. |
36,38 |
3,91 |
|
XXVIII |
3 |
ab 268 Zers. |
C7H10N4O4 |
214,03 |
50% |
ber. |
39,25 |
4,67 |
|
gef. |
38,74 |
4,57 |
|
XXIX |
5 |
276
- 279 |
C9H14N4O4 |
242,05 |
47% |
ber. |
44,62 |
5,79 |
|
gef. |
44,40 |
5,49 |
|
XXX |
10 |
239 - 242 |
C14H24N4O4 |
312,1 |
39% |
ber. |
53,84 |
7,69 |
|
gef. |
50,60 |
7,73 |
Die Synthesevorschriften für alle angeführten Verbindung
finden sich in der Dissertation von Karl-Heinz Uhl.
Chlorella-test
Zum Test kamen Verbindungen folgender Struktur:
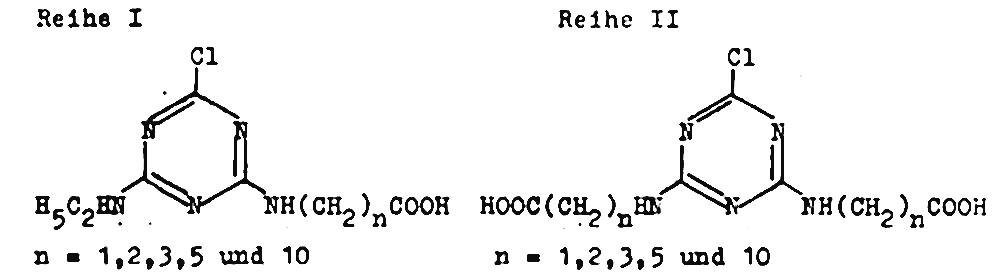
Als Vergleichssubstanz wurde Atrazin (2-Chlor-4-äthyl-amino-6-isopropylamino-s-triazin) eingesetzt. Aus dem Vergleich der Ergebnisse beider Substanzreihen geht hervor,
dass
a) die Chlorophyllsynthese durch die Verbindungen der Reihe I stärker gehemmt wird als durch Verbindungen der Reihe II. Die Schädigung der Chloroplast-Strukturen durch die getesteten Verbindungen kann als mögliche Ursache für die Ergebnisse nicht ausgeschlossen werden.
b) die Proteinsynthese durch die Verbindungen der Reihe I um etwa 50 % stärker gehemmt wird als durch die vergleichbaren Verbindungen der Reihe II.
c) die RKS-Synthese durch die Verbindungen der Reihe I mit n = 1, 3 und 5 stärker gehemmt wird als durch die vergleichbaren Verbindungen
der Reihe II. Nur für die Verbindungen mit n = 2 und 10 gilt die Umkehrung.
Aus dem Vergleich der prozentualen Hemmung der Substanzen der Reihen I und II und Atrazin gegenüber den Kontrollwerten der Stunde 4 und der Stunde 8
ergeben sich für die Substanzen folgende Werte:
Prozentuale Hemmung
Atrazin = 100 %,
Trockenmasse:
|
|
n
= 1
|
n
= 2
|
n = 3
|
n = 5
|
n
= 10
|
|
Reihe
I
|
Stunde
4 Stunde
8
|
16 %
3 %
|
69
%
38 %
|
85
%
44 %
|
66
%
58 %
|
28 %
38 %
|
|
Reihe
II
|
Stunde 4
Stunde 8
|
- 1)
11%
|
31 %
14 %
|
41 %
10 %
|
28
%
12 %
|
13 %
4 %
|
Chlorophyll:
|
|
|
n = 1
|
n = 2
|
n = 3
|
n = 5
|
n = 10
|
|
Reihe
I
|
Stunde 4
Stunde 8
|
- 1)
10
%
|
20
%
10
%
|
120
% 57
%
|
85 %
24 %
|
40 %
17 %
|
|
Reihe
II
|
Stunde 4 Stunde 8
|
5
%
18
%
|
10
%
46
%
|
70 %
11
%
|
20
%
14 %
|
1)
-
1)
|
Protein
|
|
|
n = 1
|
n = 2
|
n = 3
|
n = 5
|
n = 10
|
|
Reihe
I
|
Stunde 4
Stunde 8
|
37
%
37 %
|
78 %
43 %
|
61 %
85
%
|
39
%
89 %
|
34
%
52
%
|
|
Reihe
II
|
Stunde 4 Stunde 8
|
- 1)
17 %
|
61 %
24
%
|
41 %
35 %
|
74 %
8 %
|
32 %
24
%
|
Die Werte
gelten für die Konzentration 10-4 Gew.%.
-
1) = keine Hemmung
Aus den Ergebnissen ist weiterhin ersichtlich, dass das 2-Chlor-4-äthylamino-6-karboxypropylamino-8-triazin die stärkste
Hemmwirkung aller eingesetzten Verbindungen aufweist. Der Vergleich mit den Hemmwerten des Atrazin ergibt für das
4-Aminobutansäurederivat etwa 80 % Wirksamkeit. Der Vergleich der prozentualen Hemmung gegenüber den Kontrollwerten der
Stunde 4 und der Stunde 8 zwischen 2-Chlor-4-äthylamino-6-carboxypropylamino-8-triazin und Atrazin ergibt für das
4-Aminobutansäurederivat-folgende Werte:
|
Durchlässigkeit der Chlorella-Suspension
|
Chlorophyllsynthese
|
|
Stunde 4:
78 %
Stunde 8:
80 %
|
Stunde 4:
85 %
Stunde 8:
77 %
|
|
Trockenmasse
Stunde 4:
128 %
Stunde 8:
54 %
|
KNS-Synthese
Stunde 4:
87 %
Stunde 8:
87 %
|
Pyridin-Alkali-Reaktion,
Die bekannte Reaktion von Pyridin mit l-Chlor-2,4-di-nitrobenzol, die auf Zinke zurückzuführen ist, kann man auf die Chlortriazine
übertragen. Legradi weist nach, dass die dabei auftretende Farbreaktion pH-Wert-abhängig ist.
Zur Stabilisierung des gelbgrünen Farbkomplexes, der bei der Reaktion eines Chlortriazins mit Pyridin im basischen Milieu gebildet wird
und nach wenigen Minuten wieder zerfällt, eignen sich Verbindungen mit einer aktiven Methylen-
oder Aminogruppe. Ragab empfiehlt als Stabilisatoren
Cyanessigsäureäthylester, Barbitursäure und 2-Thiobarbitursäure. Es wurden außerdem Malonsäure, Malonsäurediäthylester, Acetylaceton, Acetessigsäureäthylester,
2-Acetylamino-5-benzy1-1,3,4-oxdiazol getestet. Der Cyanessigsäureäthylester erwies sich
aber als günstigster Stabilisator.
Der Farbkomplex ist ein Azomethinfarbstoff der im Gleichgewicht mit der entsprechenden Ketoformel steht.
Durch Kondensationsreaktionen zwischen den Stabilisatoren und der Enolform des jeweiligen Triazinderivates bleibt die Azomethingruppierung erhalten.
Die Substanzen I bis X der vorliegenden Tabellen bilden mit Pyridin ebenfalls einen gelbgrünen Farbkomplex,
der durch Zugabe von Cyanessigsäureäthylester in einen roten Farbkomplex überführt werden kann. Das Absorptionsmaximum liegt bei 550
nm.
Die Extinktionswerte sind nicht linear von der Konzentration abhängig. Die
Reaktion eignet sich aber zur quantitativen Bestimmung.
zur Startseite
 Die Herstellung des 2,4-Dichlor-6-äthylamino-s-triazins ist seit 1958
bekannt. Diese Verbindung ist die Basis für die Umsetzungen mit dem Natriumsalz
der Aminocarbonsäuren. Es erwies sich als günstiger, wenn die Synthese im
Eintopfverfahren aus Cyanurchlorid in Aceton durchgeführt wird. Die
Gesamtausbeute ist dadurch deutlich höher.
Die Herstellung des 2,4-Dichlor-6-äthylamino-s-triazins ist seit 1958
bekannt. Diese Verbindung ist die Basis für die Umsetzungen mit dem Natriumsalz
der Aminocarbonsäuren. Es erwies sich als günstiger, wenn die Synthese im
Eintopfverfahren aus Cyanurchlorid in Aceton durchgeführt wird. Die
Gesamtausbeute ist dadurch deutlich höher. Ebenfalls in Aceton kann das Cyanurchlorid mit der entsprechenden Menge des
Aminosäuresalzes bei Temperatursteigerung von -10 °C auf 45 °C und etwa
2-stündigem Rühren zur Zielverbindung umgesetzt werden.
Ebenfalls in Aceton kann das Cyanurchlorid mit der entsprechenden Menge des
Aminosäuresalzes bei Temperatursteigerung von -10 °C auf 45 °C und etwa
2-stündigem Rühren zur Zielverbindung umgesetzt werden. Die Reaktion wird in Aceton durchgeführt. Zunächst werden eine äquivalente Menge
Methylmercaptan und 5 N-Natronlauge eingerührt. Nach ein bis zwei Stunden
werden die Natriumsalzlösung der Aminocarbonsäure und Natronlauge zugegeben und
2 Stunden auf 60 °C erhitzt.
Die Reaktion wird in Aceton durchgeführt. Zunächst werden eine äquivalente Menge
Methylmercaptan und 5 N-Natronlauge eingerührt. Nach ein bis zwei Stunden
werden die Natriumsalzlösung der Aminocarbonsäure und Natronlauge zugegeben und
2 Stunden auf 60 °C erhitzt. Ohne Isolierung des Zwischenproduktes wird Cyanurchlorid in Aceton zunächst
mit Methylmercaptan/Natronlauge, dann mit Äthylamin und danach mit dem
Natriumsalz der entsprechenden Aminosäure umgesetzt.
Ohne Isolierung des Zwischenproduktes wird Cyanurchlorid in Aceton zunächst
mit Methylmercaptan/Natronlauge, dann mit Äthylamin und danach mit dem
Natriumsalz der entsprechenden Aminosäure umgesetzt. Verbindungen dieser Gruppe sind 1961 von Nestler
(Dissertation, TU Dresden) beschrieben worden.
Verbindungen dieser Gruppe sind 1961 von Nestler
(Dissertation, TU Dresden) beschrieben worden.  Die Herstellung dieser Verbindungen aus Cyanurchlorid
könnte über das zuerst gebildete Chlor-dioxo-triazin oder über das nicht
isolierbare Dichlor-carboxyalkylamino-triazin bei anschließender Hydrolyse
erfolgen. In jedem Fall verläuft aber die Hydrolyse zur Cyanursäure so schnell,
dass keine Zielverbindungen erhalten werden. Es ist sicher, dass die Carboxyl-Gruppe
die Hydrolyse katalysiert, denn der Einsatz von Derivaten der Aminosäuren, wie
Nitrile, Amide oder Ester, führt zu den entsprechenden Dioxo-Verbindungen. Die
Substanzen der folgenden Tabelle sind durch Hydrolyse der entsprechenden
Dichlor-methoxycarboalkylamino-triazinen erhalten worden.
Die Herstellung dieser Verbindungen aus Cyanurchlorid
könnte über das zuerst gebildete Chlor-dioxo-triazin oder über das nicht
isolierbare Dichlor-carboxyalkylamino-triazin bei anschließender Hydrolyse
erfolgen. In jedem Fall verläuft aber die Hydrolyse zur Cyanursäure so schnell,
dass keine Zielverbindungen erhalten werden. Es ist sicher, dass die Carboxyl-Gruppe
die Hydrolyse katalysiert, denn der Einsatz von Derivaten der Aminosäuren, wie
Nitrile, Amide oder Ester, führt zu den entsprechenden Dioxo-Verbindungen. Die
Substanzen der folgenden Tabelle sind durch Hydrolyse der entsprechenden
Dichlor-methoxycarboalkylamino-triazinen erhalten worden.