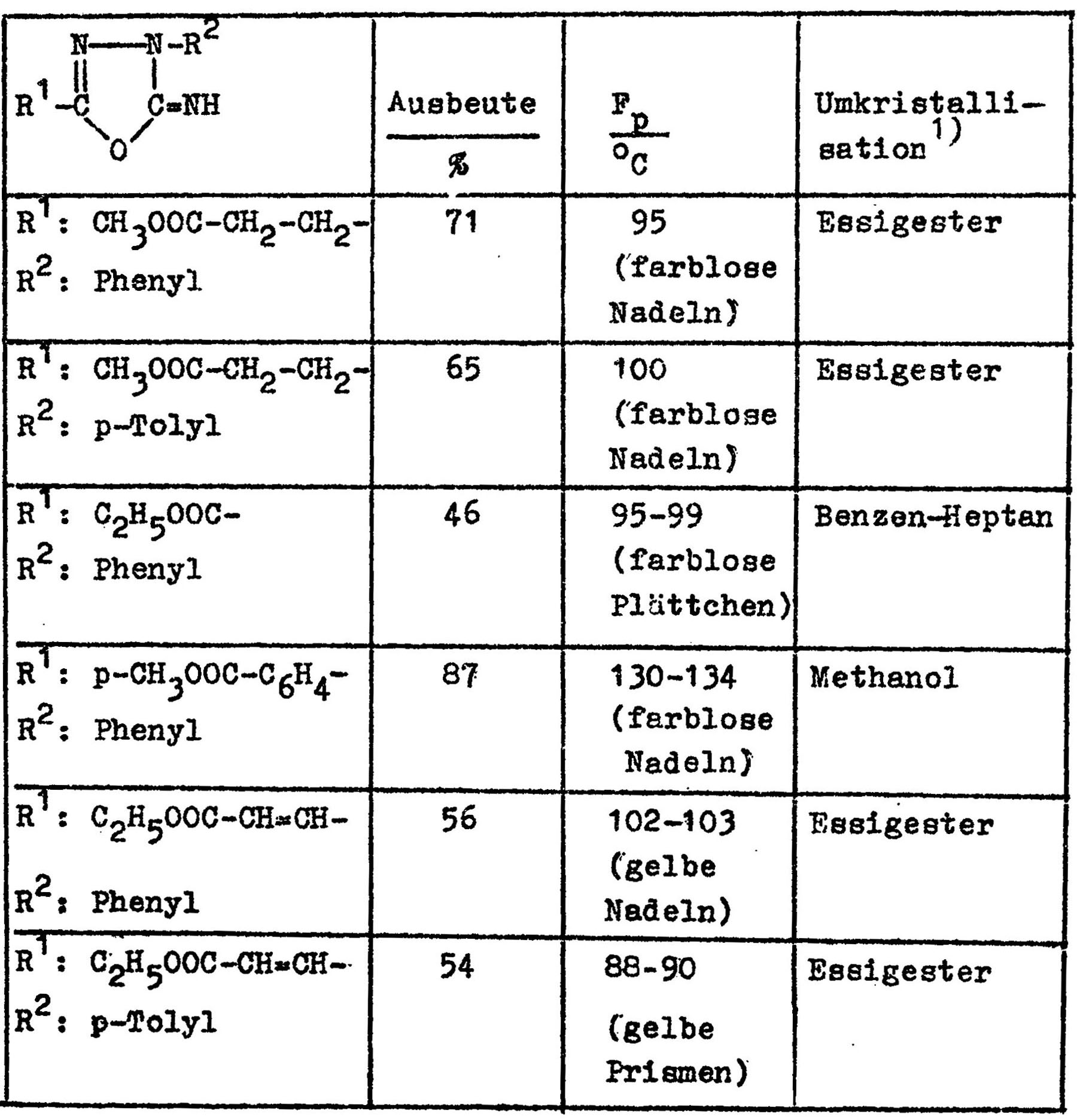
 Mit dem Ziel, asymmetrisch-substituierte Bis-iminooxadiazoline herzustellen, sind verschiedene Iminooxadiazoline mit Carbonsäureestern als Ringsubstituenten hergestellt worden, indem Cyanhydrazine mit Halogencarbonsäureestern umgesetzt wurden.
Mit dem Ziel, asymmetrisch-substituierte Bis-iminooxadiazoline herzustellen, sind verschiedene Iminooxadiazoline mit Carbonsäureestern als Ringsubstituenten hergestellt worden, indem Cyanhydrazine mit Halogencarbonsäureestern umgesetzt wurden."Zur Kenntnis der 3,5-disubstituierten 2-Imino-1,3,4-oxadiazoline ", Dissertation (1983),
Bode, Hans-Joachim , Pädagogische Hochschule Erfurt/Mühlhausen
 Mit dem Ziel, asymmetrisch-substituierte Bis-iminooxadiazoline herzustellen, sind verschiedene Iminooxadiazoline mit Carbonsäureestern als Ringsubstituenten hergestellt worden, indem Cyanhydrazine mit Halogencarbonsäureestern umgesetzt wurden.
Mit dem Ziel, asymmetrisch-substituierte Bis-iminooxadiazoline herzustellen, sind verschiedene Iminooxadiazoline mit Carbonsäureestern als Ringsubstituenten hergestellt worden, indem Cyanhydrazine mit Halogencarbonsäureestern umgesetzt wurden.
Fluoreszenz-Untersuchungen sind von den meisten neuen Substanzen durchgeführt worden.
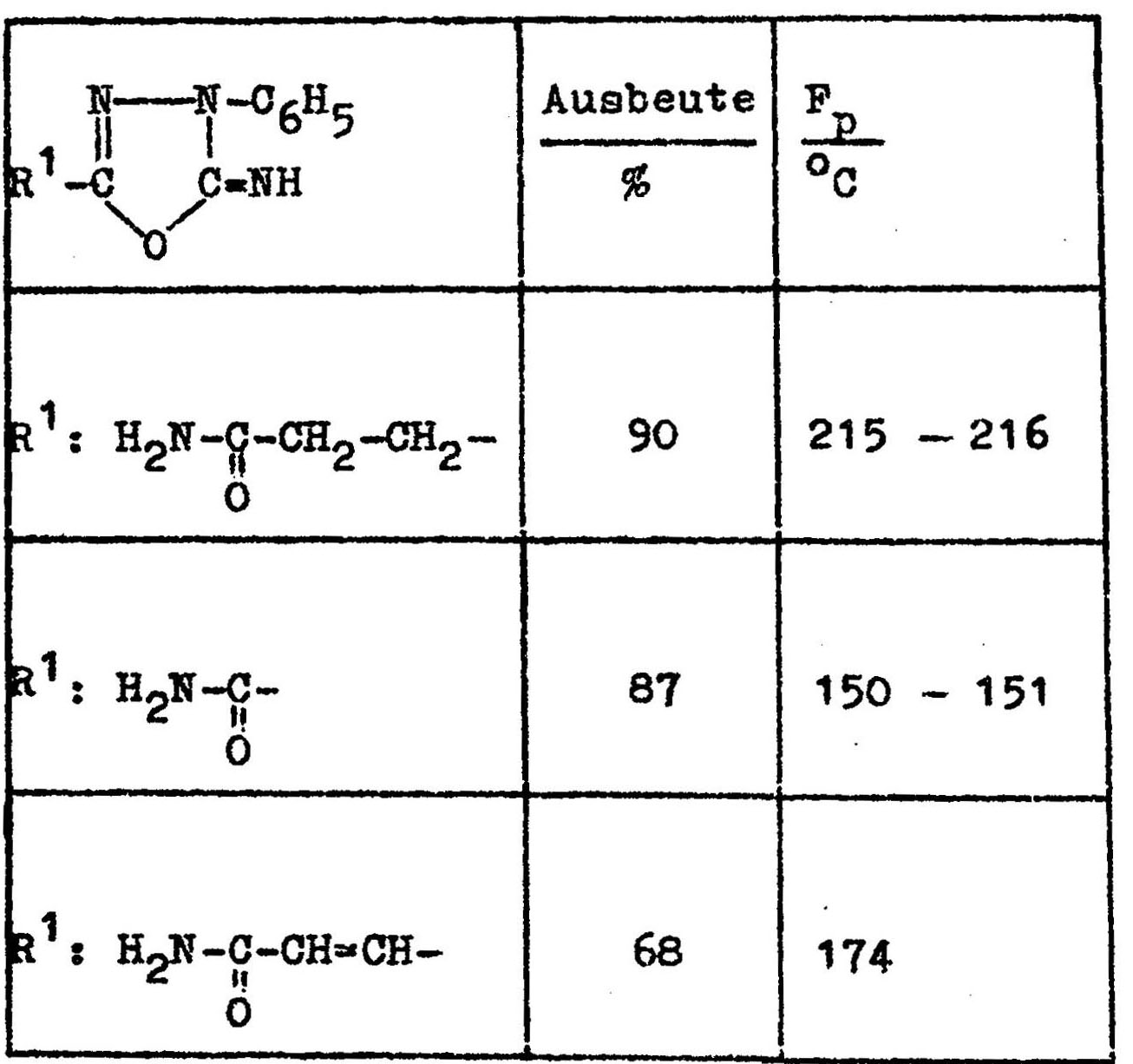 Mit Ammoniaklösung bilden sich aus den Estern die Säureamide:
Mit Ammoniaklösung bilden sich aus den Estern die Säureamide:
Mit Hydrazinhydrat werden analog Carbonsäurehydrazide erhalten.
Durch Hydrolyse mit verdünnter Salzsäure konnten nicht die 2-Imino-3-aryl-1,3,4-oxadiazolinyl-carbonsäuren isoliert werden.
Es wird zunächst die Imino-Gruppe abgespalten. Dabei bilden sich primär die carbonsäureester-substituierten Oxadiazolinone. Danach wird die Estergruppe hydrolysiert.
In sehr guten Ausbeuten werden mit Thionylchlorid in Benzol die 2-Oxo-3-aryl-1,3,4-oxadiazolin-5-yl-carbonsäurechloride gebildet. (Tabelle)
Die Umsetzung der 2-Oxo-3-aryl-1,3,4-oxadiazolin-5-yl-carbonsäurechloride mit N-Cyan-N-aryl-hydrazin führt zu den unsymmetrisch-substituierten Bis-oxadiazlinen (Tabelle)
Durch die Untersuchungen zur Alkoholyse der neu hergestellten carbonsäureester-substituierten Verbindungen wurde ein neuer Zugang zu den nicht uninteressanten 5-Alkoxy-1,2,4-triazolen gefunden. 12 beschriebene Verbindungen zeigen die Anwendungsbreite diese Verfahrens (Tabelle)
"Verfahren zur Herstellung von 1,3-disubstituierten 5-Alkoxy-1,2,4-triazolen und 1,2,4-Triazolin-5-onen"
DDR-WP C07D 226 883 (1985);Bode, Hans-Joachim; Just, Manfred