"Zur Kenntnis der kernsubstituierten
2-Amino-1,3,4-oxadiazole“, Seite 7ff,
Manfred Just, Dissertation 1963;
Universität Potsdam
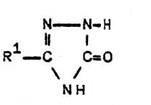
Diese Verbindungen werden durch alkalisches Verkochen von
2-Amino-1,3,4-oxadiazolen hergestellt [H. Gehlen, Ann. Chem. 563, 185 (1949)]. Sie sind
aber in einem Eintopfverfahren aus Carbonsäurehydraziden und Bromcyan in überschüssiger Natronlauge einfacher herzustellen.

1 |
3-Äthyl-1,2,4-triazol-5-on | 85 % Ausbeute bezogen auf Carbonsäurehydrazid 59 % Ausbeute bei Verseifung der Äthoxverbindung |
2 |
3-Benzyl-1,2,4-triazol-5-on | 53 % Ausbeute bezogen auf Carbonsäurehydrazid 56 % Ausbeute bei Verseifung der Äthoxverbindung |
3 |
3-Phenyl-1,2,4-triazol-5-on | 34 % Ausbeute bezogen auf Carbonsäurehydrazid 47 % Ausbeute bei Verseifung der Äthoxverbindung |
Wird anstelle von Natronlauge eine äthanolische Natriumhydroxid-Lösung zur Umsetzung von Carbonsäurehydrazid und Bromcyan verwendet, können die 3-Alkoxy-triazole isoliert werden [beschrieben von: H. Gehlen, G. Blankenstein, Ann. Chem. 651, 137 (1962)]. Bei saurer Hydrolyse entstehen daraus die entsprechenden 1,2,4-Triazol-5-one.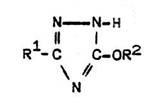
4 |
3-Äthoxy-5-äthyl-1,2,4-triazol | 59 % Ausbeute bezogen auf Carbonsäurehydrazid |
5 |
3-Äthoxy-5-benzyl-1,2,4-triazol | 63 % Ausbeute bezogen auf Carbonsäurehydrazid |
6 |
3-Äthoxy-5-phenyl-1,2,4-triazol | 62 % Ausbeute bezogen auf Carbonsäurehydrazid |
Triazolone wurden in Pyridin mit Phenylisocyanat umgesetzt. Nahezu quantitativ werden die Addukte erhalten.
Nr. |
Phenylisocyanat-Addukt aus | Ausb. % |
Summenf. Molmasse |
Analyse (ber.:/gef.:) % C % H % N |
||
7 |
3-Phenyl-1,2,4-triazol-5-on | 93 |
C15H12O2N4 280,28 |
64,28 64,31 |
4,32 5,54 |
19,99 20,14 |
8 |
3-Äthyl-1,2,4-triazol-5-on | 78 |
C11H12O2N4 232,24 |
- | - | 24,1 24,5 |
Die Reaktion von 2-Amino-oxadiazolen mit Aminen ist von H. Gehlen, E. Benatzky, Ann. Chem. 615, Seite 60 beschrieben worden. Da bei dieser Umsetzung keine einheitlichen Reaktionsprodukte entstehen, sind optimierende Untersuchungen durchgeführt worden.
"Über die Umsetzung von 2-Amino-5-methyl-1,3,4-oxadiazol mit Anilin zum 3-Anilino-5-methyl-1,2,4-triazol in Gegenwart von Schwefelsäure", Manfred Just, Diplomarbeit, 1959, Universität Potsdam.
Bei der Rektion von 2-Amino-5-methyl-1,3,4-oxadiazol mit Anilin in Gegenwart von Salz- oder Schwefelsäure bilden sich das 3-Anilino-5-methyl-1,2,4-triazol und das 4-Phenyl-5-methyl-1,2,4-triazolon-3 nebeneinander. Als Nebenprodukt entsteht N,N'-Diphenylharnstoff. Säuremenge und Reaktionszeit bestimmen die Ausbeute.
Die Tabelle zeigt die Abhängigkeit von einigen Reaktionsparametern. Zum Einsatz kamen: 2,5 gr 2-Amino-5-methyl-1,3,4-oxadiazol und 3,8 ml Anilin bei 165 °C im Ölbad. Nach Zusatz von 75 ml Wasser wurde mit dem Wasserdampf das überschüssige Anilin entfernt. Der Destillationsrückstand wird mit 5 ml konzentrierter Salzsäure erwärmt und nach Zusatz von 20 ml Wasser der wenig lösliche Diphenylharnstoff abgetrennt. Beim Abkühlen fällt nach längerem Stehen das Triazolon aus. Nach dem Neutralisieren mit Ammoniaklösung wird das Triazol als Niederschlag erhalten.
| 4n H2SO4 ml |
Rkt.-Dauer Std. |
Diphenyl- harnstoff (gr) |
Triazol gr |
Triazolon gr |
|---|---|---|---|---|
| 0,1 | 0,5 | 0,11 | 0,55 | 1,15 |
| 0,1 | 2 | 0,0 | 0,60 | 1,17 |
| 0,1 | 6 | 0,0 | 0,44 | 1,09 |
| 0,1 | 18 | 0,0 | 0,16 | 1,1 |
| 1,0 | 0,5 | 0,04 | 0,74 | 0,26 |
| 1,0 | 2 | 0,23 | 1,10 | 0,38 |
| 1,0 | 6 | 0,42 | 1,08 | 0,37 |
| 1,0 | 18 | 0,65 | 1,1 | 0,13 |
| 10 | 2 | 0,04 | - | - |
In konzentrierter Schwefelsäure, die mit sehr wenig Oxydationsmittel (Chromat, Cer(IV)-sulfat, Mangan(IV)-oxyd) versetzt ist, gibt das Triazolon im Unterschied zum Triazol eine intensive Violettfärbung. Die violette Färbung durch den Diphenylharnstoff verschwindet rasch wieder. Damit kann recht schnell die Reinheit des Triazols nachgewiesen werden.