"Zur Kenntnis von Nß-Acylhydrazino-s-triazinen" Dissertation (1975), Lutz
Bösenberg, Pädagogische Hochschule Erfurt/Mühlhausen
"Herbizides Mittel
(Acylhydrazino-s-triazine)" DDR-Patent A01N 206 317 (25.01.1984)
Gräser, Heinz; Bösenberg, Lutz u.a.
Nach der Entdeckung der herbiziden Eigenschaften einiger Triazinderivate in der 50er Jahre erfolgte ein Fülle von Veröffentlichungen zur Triazinchemie. Besonders Diamino-triazine mit Chlor oder Alkoxy-, Aryloxy- Alkylthio- und Arylthio-Substituenten wurden beschrieben. Wenig berücksichtigt wurden jedoch die Triazine mit Acylhydrazino-Gruppen. In einem Britischen Patent (942 961) der CIBA von 1961 wurden zahlreiche Acylhydrazino-triazine mit zwei teriären Aminogrupen geschützt. Beech beschrieb 1967 die Synthese des Benzoylhydrazino-triazins mit Chlor, Diäthylamin- und Chlorphenoxy-Gruppen. Dovlatjan/Chactrjan stellten 1971 Acetylhydrazino-triazine mit Chlor, Mercapto- und Aminogruppen her. Die beschriebenen Acylhydrazino-triazine wurden bei der angegebenen Substituenten-Kombination durch Acylierung von Hydrazino-triazinen hergestellt. Auf diesem Syntheseweg sind aber nur bestimmte Triazine zugängig.
Die direkte Einführung von Acylhydrazino-Gruppen bringt dagegen Zugang zu neuen Triazinen.

Die Synthese des 2,4-Dichlor-6- acylhydrazino-s-triazins durch Acylierung des entsprechenden 2,4-Dichlor-6-hydrazino-s-triazins ist nicht möglich, weil das Primärprodukt nicht hergestellt werden kann. Beech hat für das Benzoylhydrazino-triazin die Bindung am β-Stickstoffatom beschrieben, obwohl zum Beispiel die Bromcyananlagerung an das Benzhydrazid am α-N-Atom erfolgt, wie 1949 Gehlen beschrieb. Auch eine Ringaufspaltung nach Grundmann/Kreuzberger (1967) wäre möglich. Allein diese Feststellungen machten die Untersuchung der Reaktion von Carbonsäurehydraziden mit Cyanurchlorid interessant.
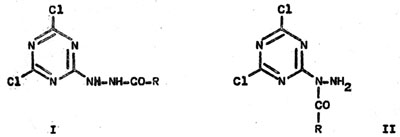 Bei
der Reaktion von Acylhydrazinen mit Cyanurchlorid sind die Produkte I und II
möglich. Mittels der 1H-NMR-Spektroskopie konnte zweifelsfrei die Verbindung 1
als einziges Reaktionsprodukt festgelegt werden. Ringspaltungen wurden nicht
beobachtet.
Bei
der Reaktion von Acylhydrazinen mit Cyanurchlorid sind die Produkte I und II
möglich. Mittels der 1H-NMR-Spektroskopie konnte zweifelsfrei die Verbindung 1
als einziges Reaktionsprodukt festgelegt werden. Ringspaltungen wurden nicht
beobachtet.
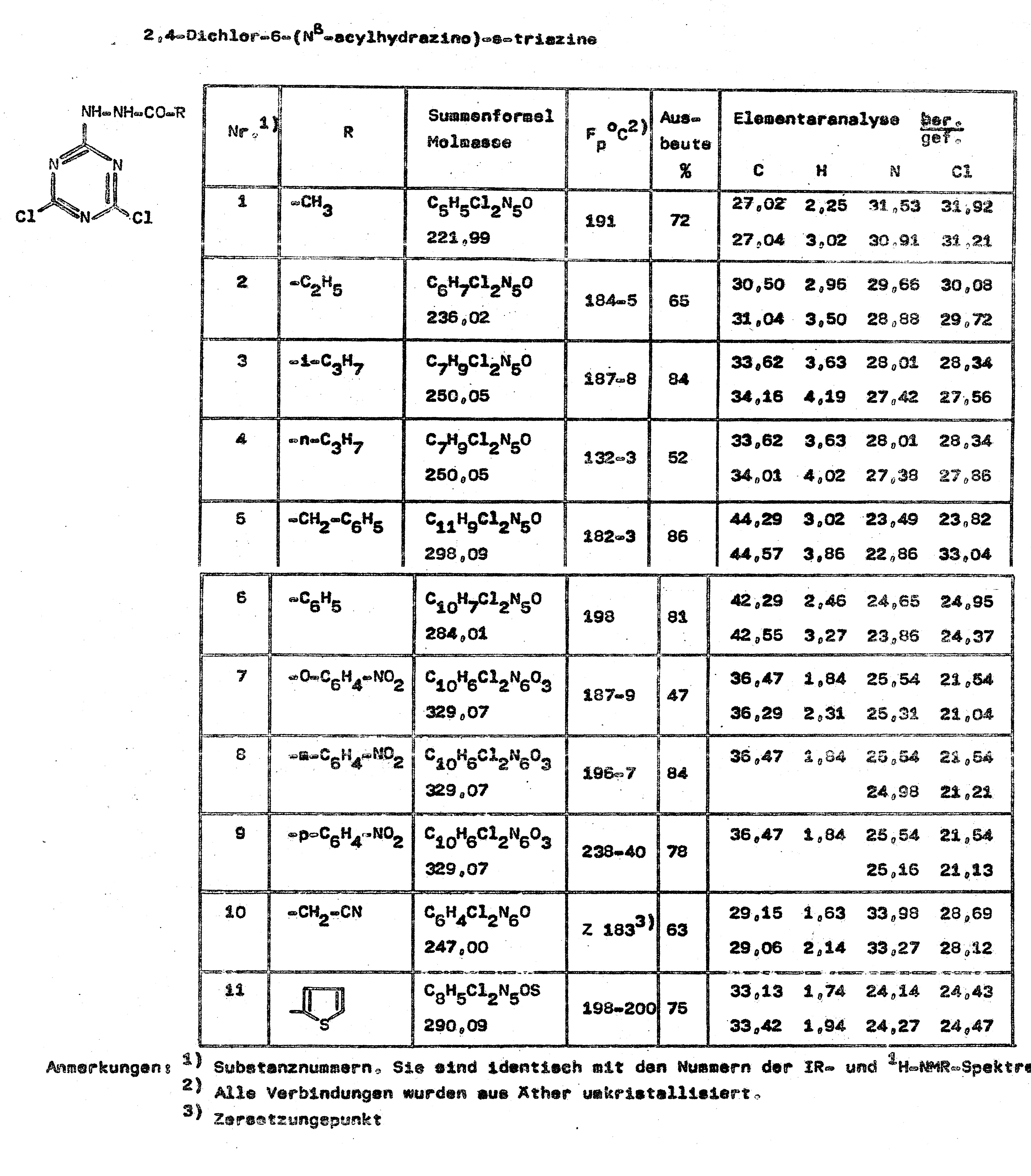
Während die Hydrazide aromatischer Carbonsäuren in Aceton mit Cyanurchlorid und einem Äquivalent Natronlauge mit guten Ausbeute reagieren, versagte diese Methode bei Hydraziden aliphatischer Carbonsäuren. In umfangreichen Versuchsreihen wurde auch deren Umsetzung optimiert. Nach der entwickelten Methode sind nun die Triazinverbindungen mit aliphatischen Carbonsäurehydraziden reproduzierbar gut zugängig, wie die folgende Tabelle zeigt:
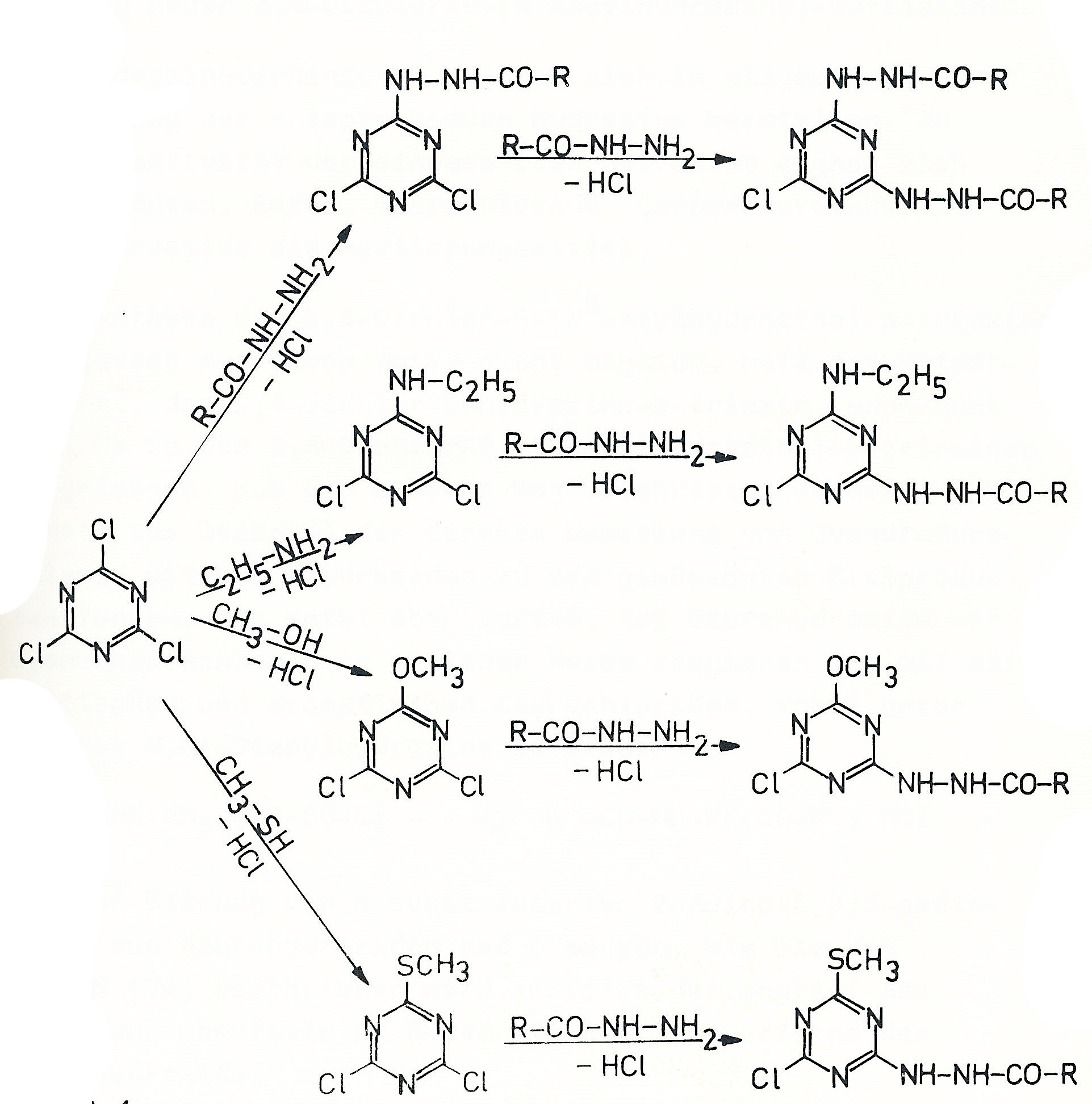
Zur Synthese sind zwei Wege möglich:
- Umsetzung mit Acylhydrazid dann
Umsetzung mit Äthylamin
- Umsetzung mit Äthylamin dann Umsetzung mit
Acylhydrazid
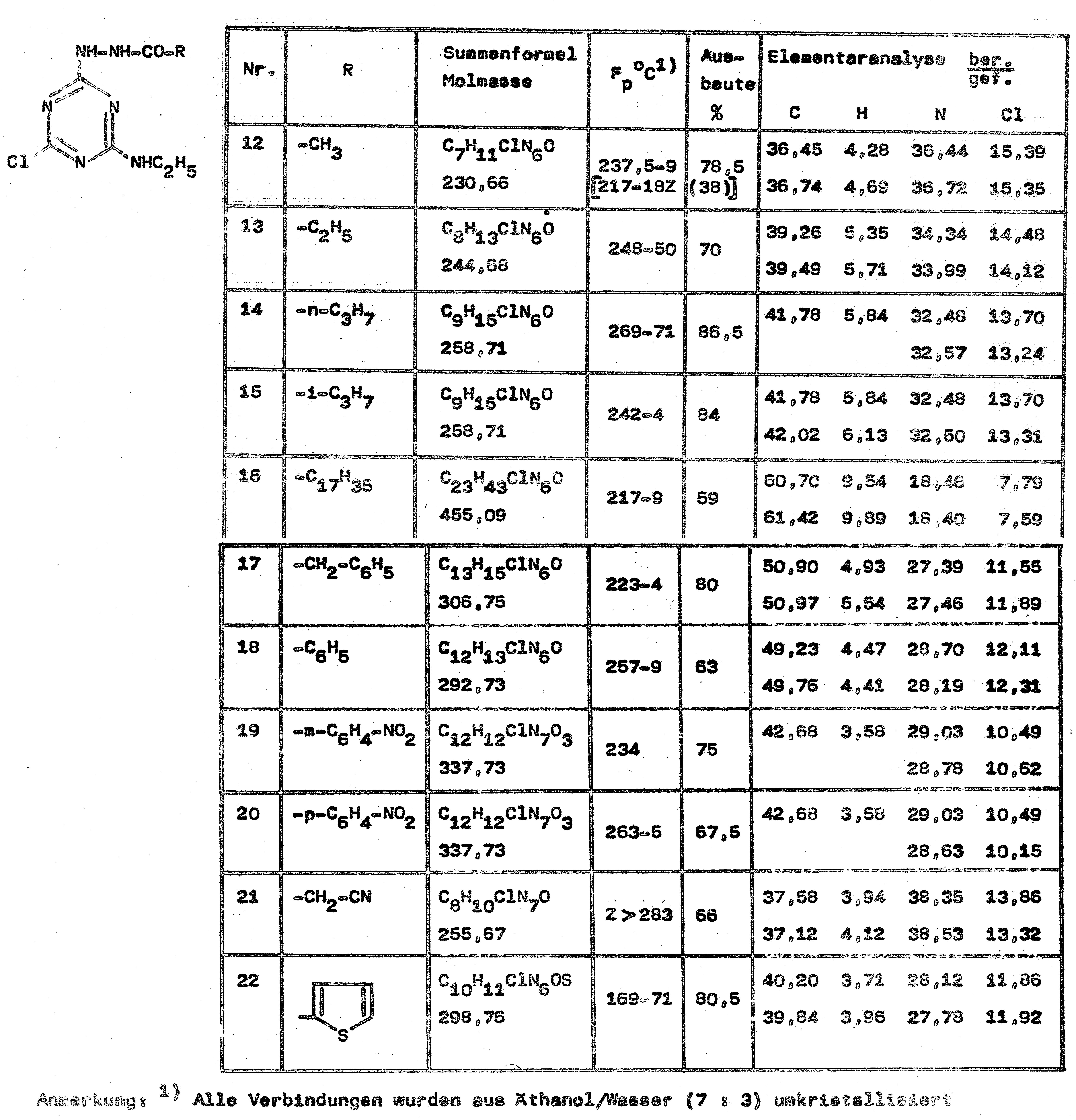
Der zweite Weg erwies sich in Bezug auf die Gesamtausbeute
günstiger. Die folgende Tabelle zeigt die Anwendungsbreite der entwickelten
Methode:
Das 2,4-Dichlor-6-methoxy-s-triazin reagiert in einem Dioxan/Wasser-Gemisch mit mittleren Ausbeute zu den entsprechenden Acylhydrazino-Derivaten.
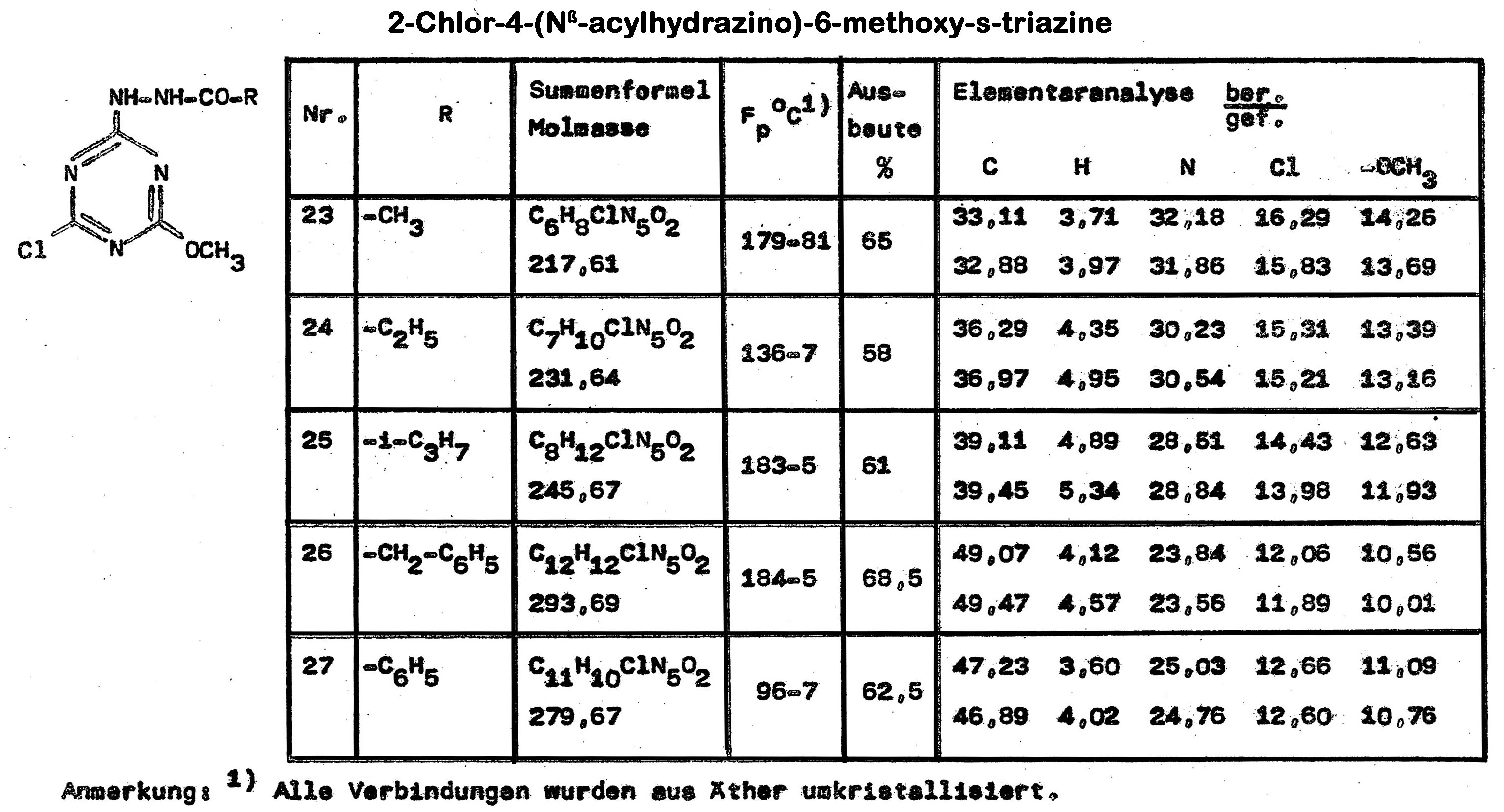
Unter gleichen Reaktionsbedingungen sind im Isopropanol/Wasser-Gemisch aus 2,4-Dichlor-6-(Nß-acylylhydrazino)-s-triazin mit Methylmecaptan die 2-Chlor-4-(Nß-acylhydrazino)-6-mercapto-s-triazine zugängig.
Zur Herstellung dieser Verbindungen wird zunächst nach dem erprobten Verfahren das Cyanurchlorid zum Mono-acylhydrazino-s-triazin umgesetzt und dann im Eintopfverfahren bei höherer Temperatur ein weiteres Äquivalent des Acylhydrazins zur Reaktion gebracht.
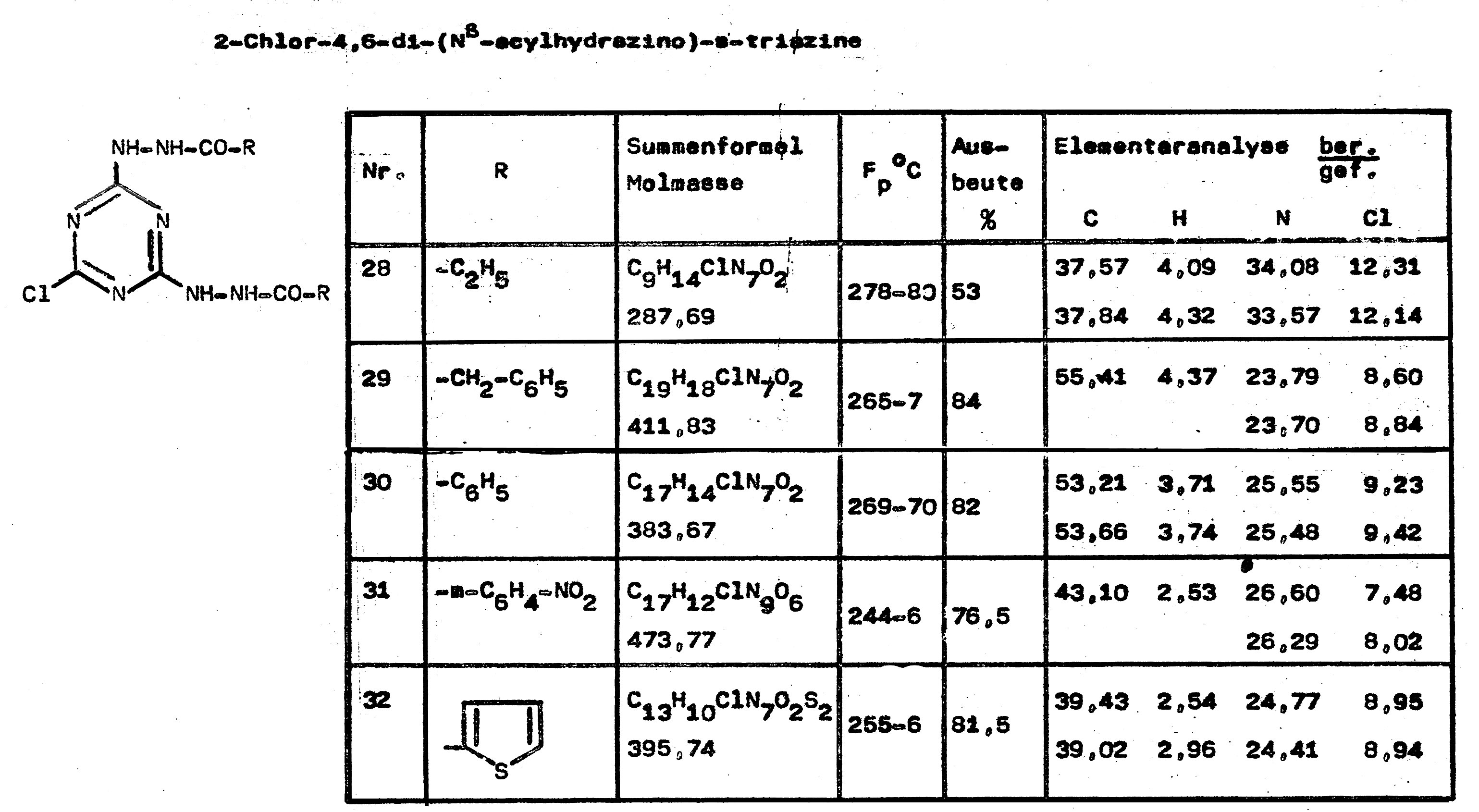
Mit diesem Syntheseweg ist auch die Anlagerung unterschiedlicher Acylhydrazine an das Cyanurchlorid möglich
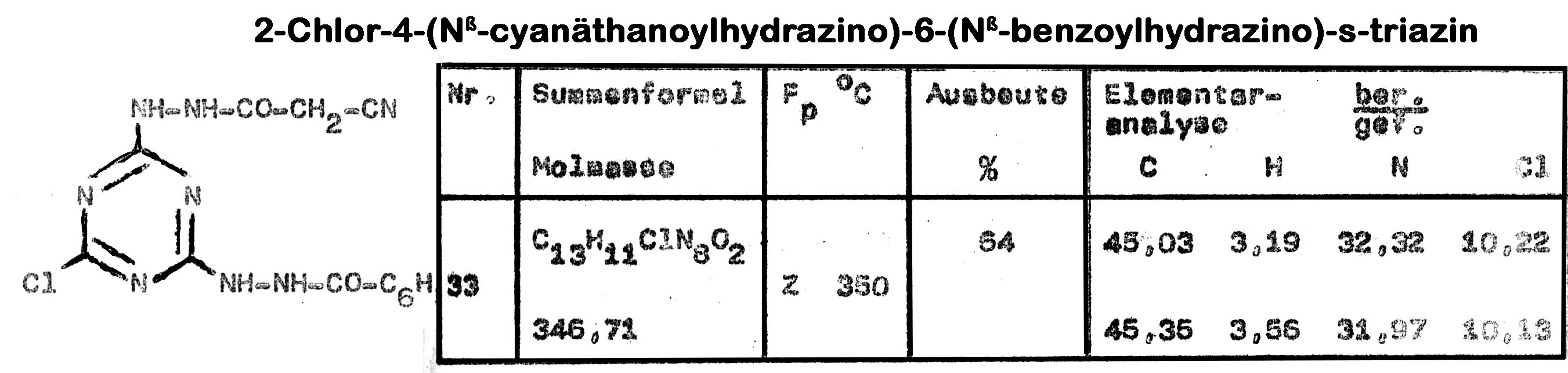
Die hergestellten Verbindungen wurden im Chlorella-Test auf ihre Wachstumsbeeinflussung untersucht. Dabei zeigte das 2,4-Dichlor-6-(Nß-thenoylhydazino)-s-triazin eine erstaunlich hohe Hemmung mit 91% im Vergleich zu Atrazin (62%) und Simazin (70%).