zur Startseite
2-Imino-1,3,4-oxadiazolin-substituierte 1,3,5-Triazine
"Zur Kenntnis
2-imino-1,3,4-oxadiazolin-substituierter 1,3,5-Triazine";
Jürgen Hollstein,
Dissertation (1984), Pädagogische Hochschule Erfurt
"Verfahren zur Herstellung von
s-triazinyl-substituierten 2-Imino-1,3,4-oxadiazolinen";
DDR-Wirtschaftspatent 251 979; 02.12.1987;
Just, Manfred; Hollstein, Jürgen; Langer,
Roselore
"Verfahren zur Herstellung von s-triazinyl-substituierten
Bis-(2-imino-1,3,4-oxadiazolinyl)-alkanen, -alkenen oder -arenen";
DDR-Wirtschaftspatent 251 979; 02.12.1987;
Just, Manfred; Hollstein, Jürgen; Langer,
Roselore
Bei der Umsetzung von Cyanurchlorid mit 5-substituierten
2-Amino-1,3,4-oxadiazolen bilden sich die Zielverbindungen nur mit unbedeutenden
Ausbeuten in einem sehr uneinheitlichen Reaktionsgemisch.
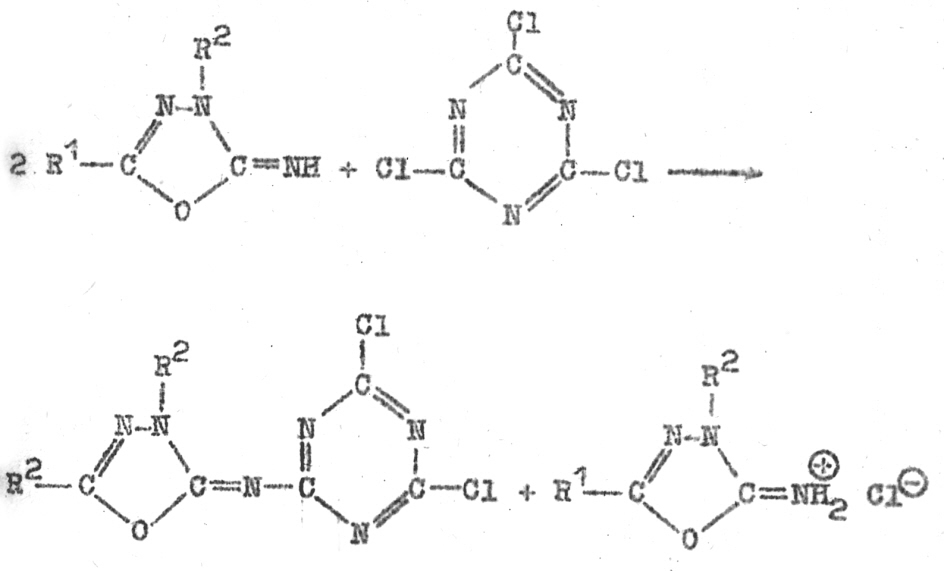 Die
3,5-disubstituierten 2-Imino-1,3,4-oxadiazoline bilden dagegen in übersichtlicher
Reaktion mit Cyanurchlorid (in Aceton gelöst) die enstsprehenden 2-substituierten 4,6-Dichlortriazine.
Sie werden abgesaugt und mit Wasser und Ethanol gewaschen. Durch
Umkristallisieren aus Nitromethan werden die unlöslichen Hydrolyseprodukte
entfernt.
Die
3,5-disubstituierten 2-Imino-1,3,4-oxadiazoline bilden dagegen in übersichtlicher
Reaktion mit Cyanurchlorid (in Aceton gelöst) die enstsprehenden 2-substituierten 4,6-Dichlortriazine.
Sie werden abgesaugt und mit Wasser und Ethanol gewaschen. Durch
Umkristallisieren aus Nitromethan werden die unlöslichen Hydrolyseprodukte
entfernt.
Durch
Zusatz von Alkalilauge oder -carbonat kann das gesamte Imino-oxadiazolin
umgesetzt werden.
Bei entsprechendem Basenzusatz können die primär
gebildeten Iminooxadiazolin-Salze (siehe 2-Imino-1,3,4-oxadiazoline) direkt eingesetzt werden.
Die unbeständigen Dialkyl-imino-oxadiazoline sind als Substituenten am Triazin
beständig (siehe Tabellen). Es wird aber immer nur das erste Chloratom
ausgetauscht unabhängig von der Art des Imino-oxadiazolins.
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
In den folgenden Tabellen werden Synthese-Beispiele für
die oben genannten Reaktionen gezeigt.
2-[3-Methyl-5-(subst. aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
2-[3-Ethyl-5-(subst. aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
2-[3-Phenyl-5-(subst. aryl,alkyl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
2-[3-Methyl-5-alkyl-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
Reaktion von
Bis-iminooxadiazolinen mit Cyanurchlorid
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4-hydroxy-6-chlor-1,3,5-triazine
Die
Hydrolyse des zweiten Chloratoms am Triazin verläuft als Konkurenzreaktion zur
Umsetzung der Iminooxadiazoline. Nach etwa 45 Minuten steigt der Anteil des
Hydroxy-triazins beträchtlich. Im Gegensatz zu den Ausgangsverbindungen sind
die Hydroxy-triazine nicht in Nitromethan löslich. Der Unterschied bei den
Schmelzpunkten ist unbedeutend.
Tabelle 12 zeigt die
hergestellten Verbindungen.
Reaktion der 2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit aliphatischen Aminen
Die
Aminolyse der Chloratome am oxadiazolin-substituierten Triazin ist mit
aliphatischen Aminen leicht möglich. Sie erfolgt in Aceton-Lösung bei 50 Grad
mit sehr guten Ausbeuten.
Tabelle
20 zeigt die hergestellten Verbindungen.

Reaktion der 2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit N-Methylanilin
Die
Reaktion mit N-Methylanilin ergab auch bei variierten Reaktionsbedingungen stets
ein Gemisch (Tabelle 21)
 Reaktion der 2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit aromatischen Aminen
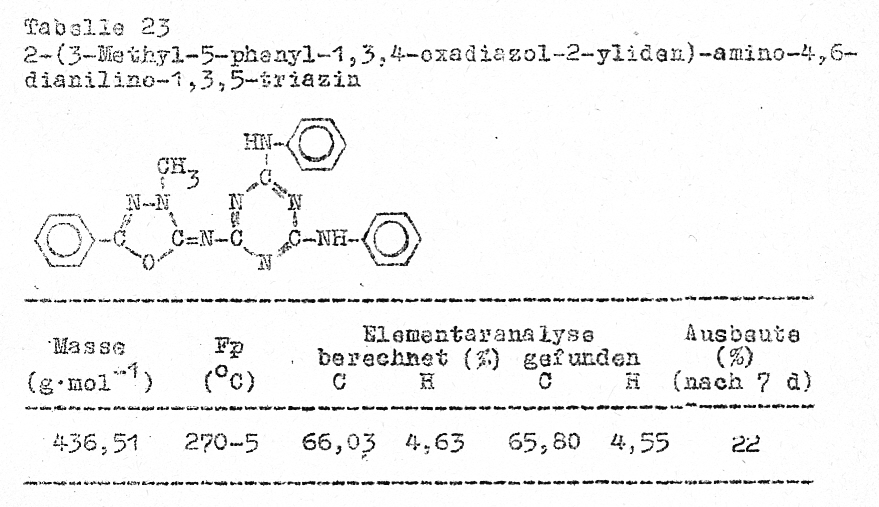
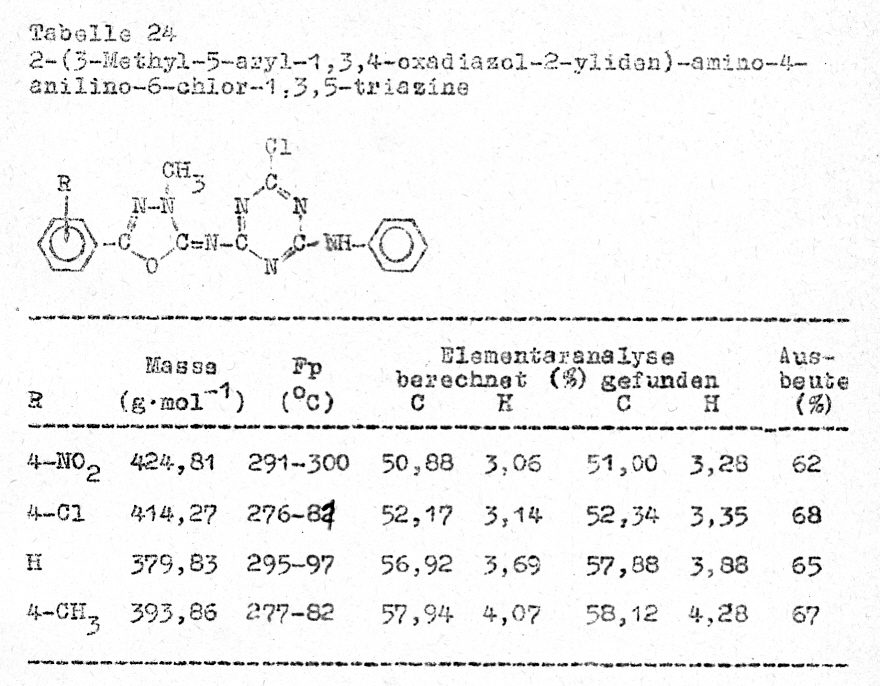
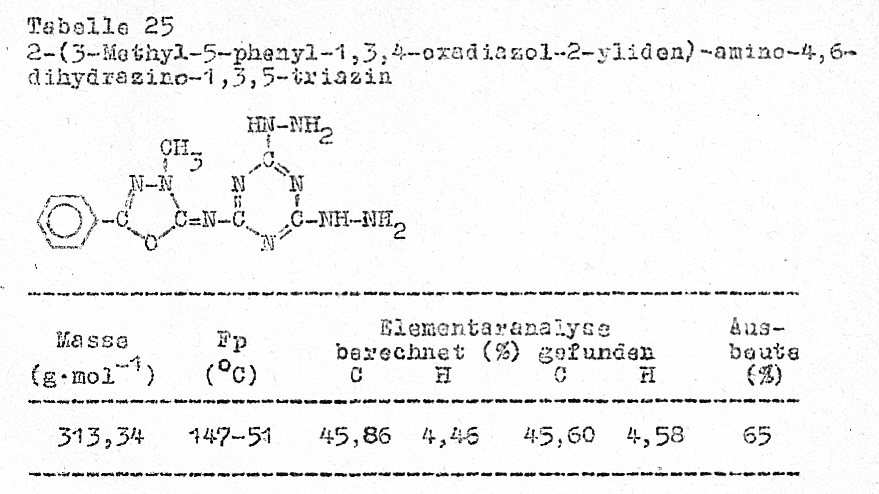
Reaktion der 2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit aromatischen Aminen
Die
Aminolyse der Chloratome am oxadiazolin-substituierten Triazin ist auch mit
aromatischen Aminen möglich. Je nach Reaktionsführung ist der Austausch beider(Tabelle 23)
oder nur eines Chloratomes möglich (Tabelle 24) .
 Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Hydrazin
Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Hydrazin
Mit Hydrazin werden beide Choratome
ersetzt, ohne das eine Abstufung möglich war (Tabelle
25).
 Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Phenol
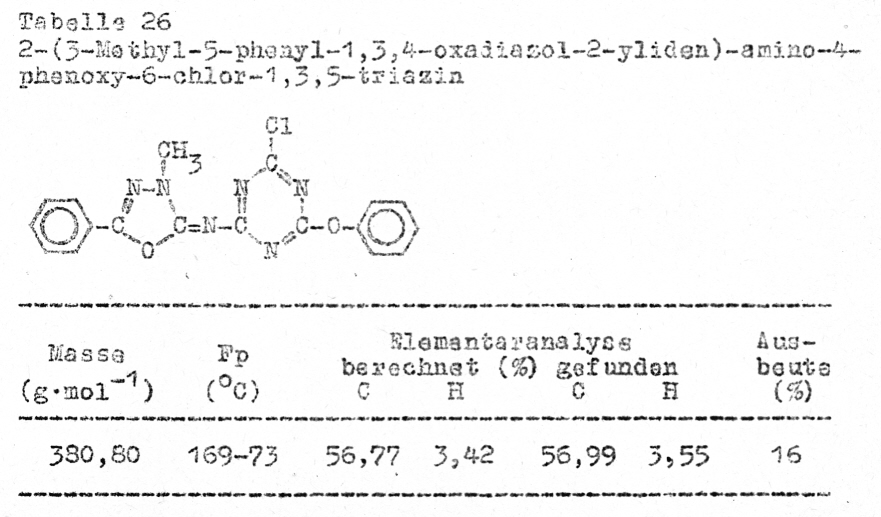
Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Phenol
Eine
Phenoxyverbindung war trotz optimierten Reaktionsbedingungen nur in schlechter
Ausbeute herstellbar (Tabelle 26).
 Die
3,5-disubstituierten 2-Imino-1,3,4-oxadiazoline bilden dagegen in übersichtlicher
Reaktion mit Cyanurchlorid (in Aceton gelöst) die enstsprehenden 2-substituierten 4,6-Dichlortriazine.
Sie werden abgesaugt und mit Wasser und Ethanol gewaschen. Durch
Umkristallisieren aus Nitromethan werden die unlöslichen Hydrolyseprodukte
entfernt.
Die
3,5-disubstituierten 2-Imino-1,3,4-oxadiazoline bilden dagegen in übersichtlicher
Reaktion mit Cyanurchlorid (in Aceton gelöst) die enstsprehenden 2-substituierten 4,6-Dichlortriazine.
Sie werden abgesaugt und mit Wasser und Ethanol gewaschen. Durch
Umkristallisieren aus Nitromethan werden die unlöslichen Hydrolyseprodukte
entfernt.


 Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Hydrazin
Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Hydrazin Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Phenol
Reaktion der
2-[3,5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yliden]-amino-4,6-dichlor-1,3,5-triazine
mit Phenol