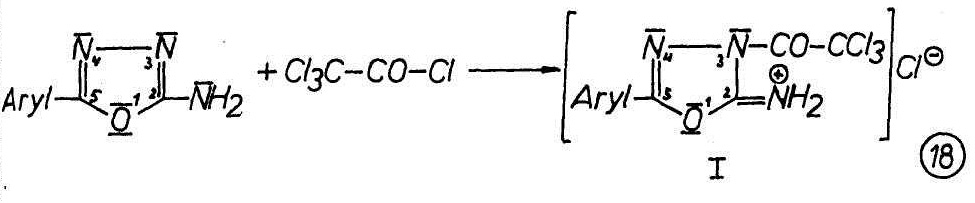
Mit Trichloracetylchlorid bilden sich je nach Reaktionsbedingungen sowohl die 5-Aryl-2-imino-3-trichloracetyl-1,3,4-oxadiazolinhydrochloride (I), als auch die 5-(Alkyl-aryl)-2-trichloracetylamino-1,3,4-oxadiazole (II).
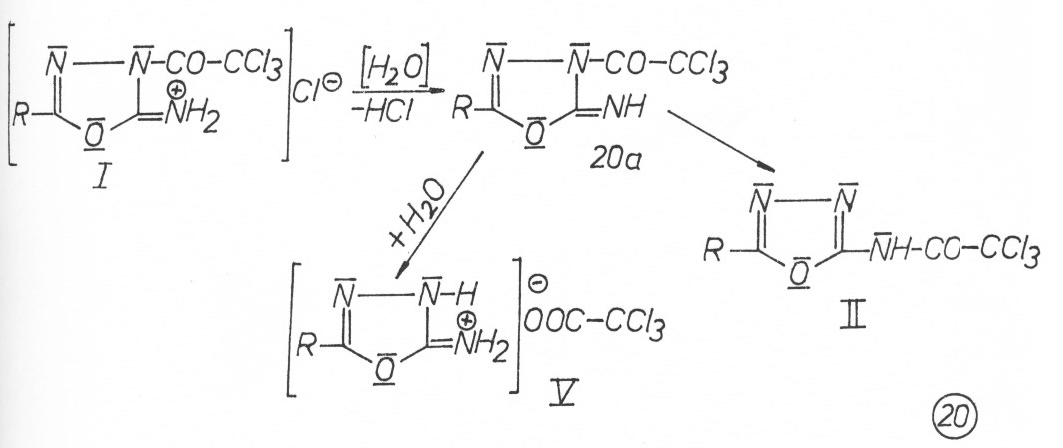
Bei der Umsetzung von 2-Amino-5-aryl-1,3,4-oxadiazolen mit Trichloracetylchlorid, ohne Lösungsmittel beim Raumtemperatur, werden die erwarteten 5-Aryl-2-imino-3-trichloracetyl-1,3,4-oxadiazolinhydrochloride (I) in exothermer Reaktion erhalten (18).

Bei aliphatisch substituiertem Oxadiazolrest sind die Hydrochloride I so unbeständig, dass sie kaum rein zu isolieren sind. Die aromatisch substituierten Verbindungen I sind ebenfalls instabil. Sie können jedoch isoliert und kurzfristig aufbewahrt werden.
| Nr. | R | Fp (°C) | Ausbeute (%) |
| 1 | methyl | Z.(87) | 78 |
| 2 | ethyl | Z.(92) | 96 |
| 3 | n-propyl | Z.(135) | 90 |
| 4 | i-propyl | Z.(71) | 89 |
| 5 | i-butyl | Z.(104) | 69 |
| 6 | benzyl | Z.(105) | 100 |
| 7 | phenyl | Z.(185) | 93 |
| 8 | o-chlorphenyl | Z.(162) | 94 |
| 9 | m-chtorpnenyl | Z.(180) | 90 |
| 10 | p-chlorphenyl | Z.(170) | 89 |
| 11 | o-nitrophenyl | Z.(182) | 72 |
| 12 | m-nitrophenyl | Z.(178) | 84 |
| 13 | p-nitrophenyl | Z.(196) | 82 |
| 14 | o-methoxyphenyl | Z.(191) | 92 |
| 15 | m-methoxyphenyl | Z. (215) | 95 |
| 16 | p-methylphenyl | Z.(226) | 97 |
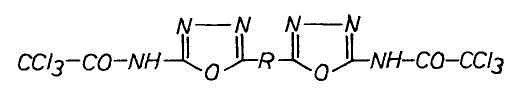
| Nr. | R | Fp (°C) | Ausbeute (%) |
| 1 | ethylen | Z. | 33 |
| 2 | n-propylen | Z. (123-125) | 80 |
| 3 | n-butylen | 190-192 | 27 |
| 4 | p-phenylen | 135 | 88 |
Z. = Zersetzung