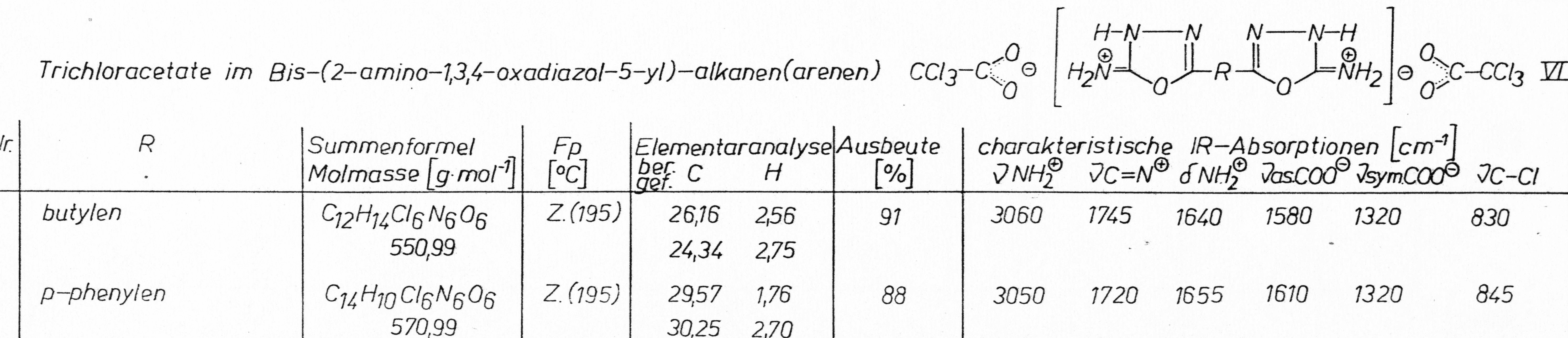
Sowohl 2-Amino-1,3,4-oxadiazole als auch 2-Imino-1,3,4-oxadiazoline können Salze bilden. In ihren pKa-Werten unterscheiden sich beide Verbindungsklassen beträchtlich. So liegen die pKa-Werte von 2-Amino-1,3,4-oxadiazolen deutlich niedriger als die der basischeren 2-Imino-1,3,4-oxadiazoline. pKa-Werte ausgewählter 2-Amino-1,3,4-oxadiazole und 2-Imino-1,3,4-oxadiazoline geben Tab. 6 und 7.
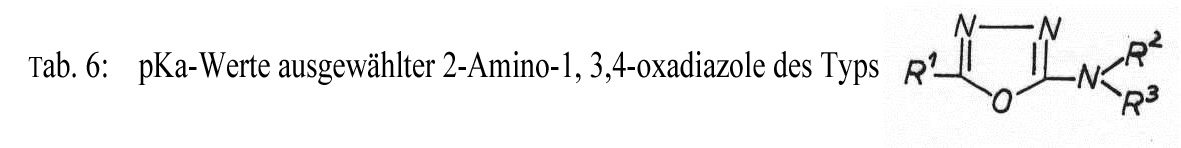
| R1 | R2 | R3 | pKa | (T °C) |
| H methyl ethyl phenyl phenyl phenyl | H H H H phenyl methyl | H H H H H methyl | 2,22 2,82 2,94 1,31 0,32 2,02 | (22) (22) (22) (22) (23) (20) |
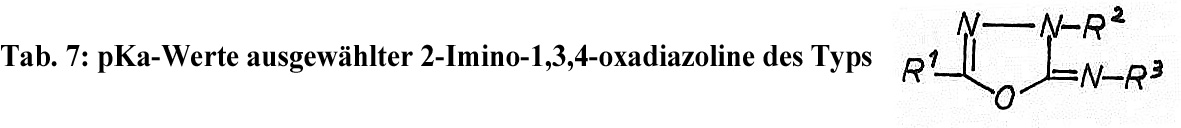
| R1 | R2 | R3 | pKa | (T °0) |
| H benzyl phenyl phenyl p-methoxy-phenyl | methyl phenyl phenyl ethyl methyl | phenyl H H H H | 4,12 5,80 5,72 6,18 6,75 | (20) (25) (25) (25) (25) |
Die Synthese der Trichloracetate erfolgt durch Umsatz äquimolarer Mengen fester Trichloressigsäure mit feingepulvertem 5-(Alkyl,aryl)-2-amino-1,3,4-oxadiazol
in einem wasserfreien unpolaren Lösungsmittel wie n-Heptan oder Benzen auf dem Schütteltisch bei Raumtemperatur.
Bei Anwesenheit von Feuchtigkeit entstehen die Monohydrate der Trichloracetate. Dihydrate konnten nicht beobachtet
Die Trichloracetat-Monohydrate lassen sich zu den wasserfreien Trichloracetaten entwässern, wenn sie bis ca. 100 °C erwärmt werden. Bei höheren Temperaturen beginnt bereits
die Zersetzung unter Abspaltung von Trichloressigsäure.
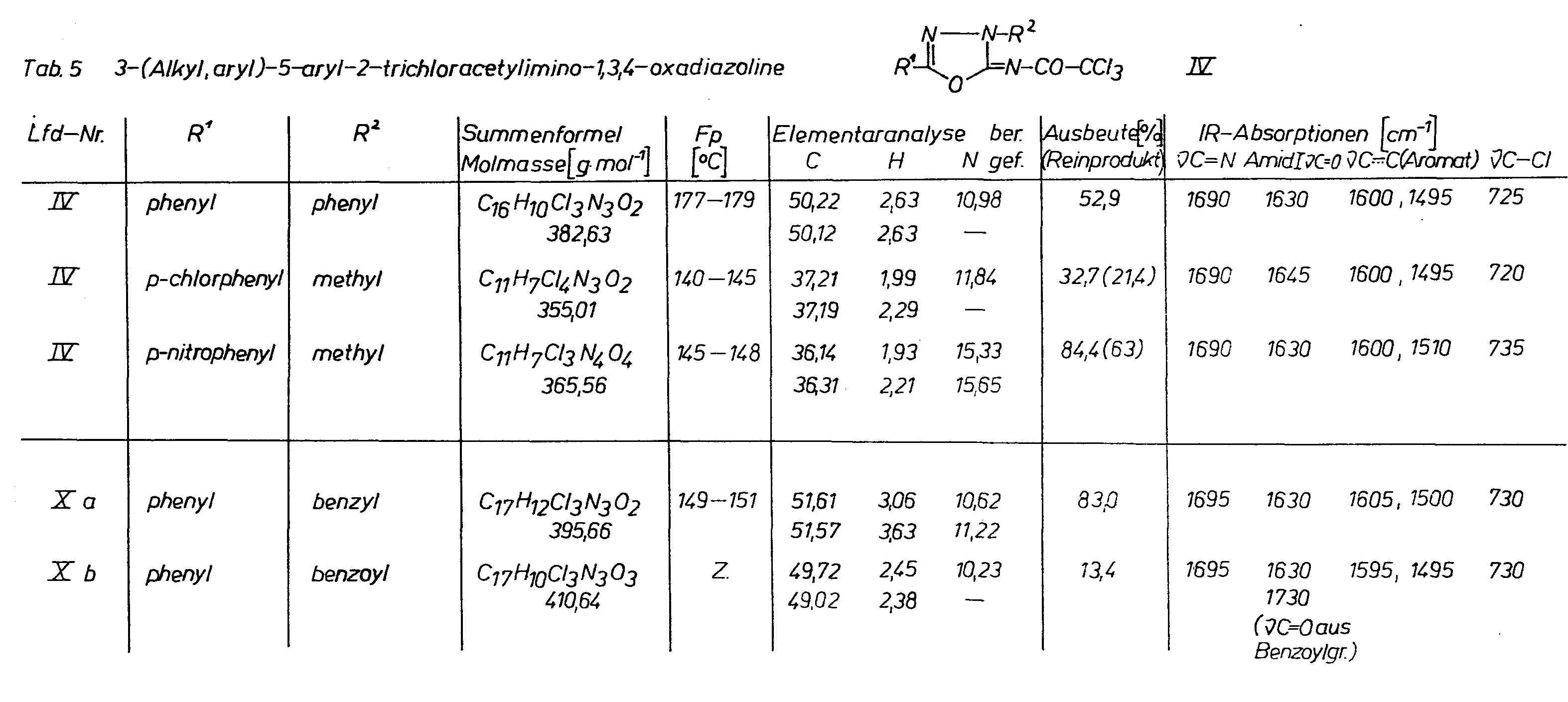
Die 5-(Alkyl,aryl)-1,3,4-oxadiazolinyl-2-immoniumtrichloracetate sind Hydrolyseprodukte der entsprechenden
5-(Alkyl,aryl)-2-trichloracetylamino-1,3,4-oxadiazole II.Diese Reaktion ist umkehrbar und ermöglicht die Herstellung der Verbindungen II aus
5-(Alkyl,aryl)-2-amino-1,3,4-oxadiazolen und Trichloressigsäure. Es erübrigt
sich damit der Einsatz des Trichloracetylchlorids. Zweckmäßig ist die Dehydratisierung mit Thionylchlorid (30).
Die thermische Stabilität der Trichloracetate V ist gering.
Sie zeigen keinen Schmelzpunkt, sondern zersetzen sich unter Trichloressigsäureabspaltung ab ca. 100 °C. Die Monohydrate spalten vorher ab ca. 60 °C
das Kristallwasser ab, bevor auch sie sich zersetzen.
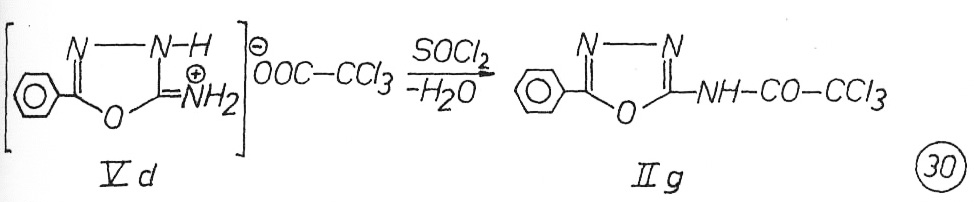
Die 3-Alky-5-aryl-2-imino-1,3,4-oxadiazoline bilden ebenfalls Trichloracetate, die ein ähnliches IR-spektroskopisches und chemisches Verhalten zeigen wie die Trichloracetate der 2-Amino-1,3,4-oxadiazole (Tab. 10 und 11)