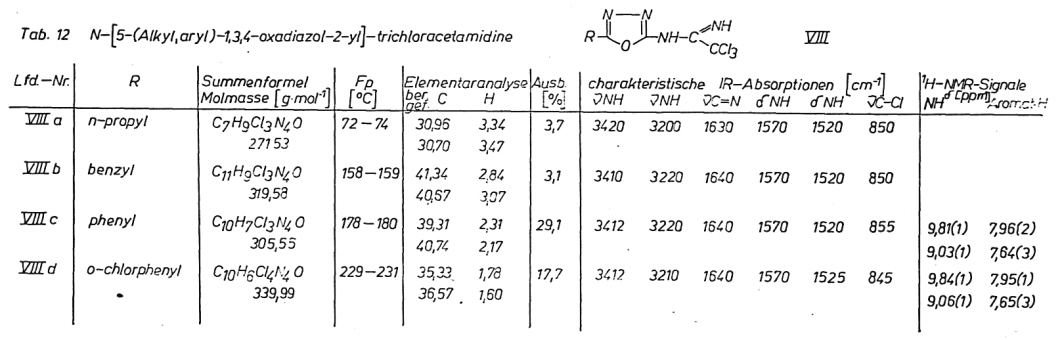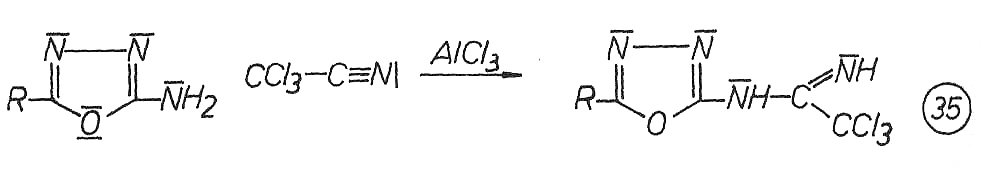
Obwohl Trichloracetamidine biologisch wirksame Substanzen darstellen, liegen über N-heterocyclisch substituierte Trichloracetamidine kaum Literaturangaben vor. Während 2-Amino-5-methyl-pyrimidin
und 2-Amino-thiazol auch ohne Katalysator mit Trichloracetonitril zu den entsprechenden Trichloracetamidinen umgesetzt werden konnten, gelang eine analoge
Umsetzung von 5-(Alkyl,aryl)-2-amino-1,3,4-oxadiazolen weder ohne Lösungsmittel noch bei Einsatz von Benzen oder DMF als Lösungsmittel. Das eingesetzte 2-Amino-1,3,4-oxadiazol
wurde in allen Fällen unverändert zurückerhalten.
Erst bei der Umsetzung von äquimolaren Mengen an Trichloracetonitril, 5-(Alkyl,aryl)-2-amino-1,3,4-oxadiazol
und wasserfreiem
Aluminiumchlorid wurden die gesuchten N-[5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yl]-trichloracetamidine erhalten (35). Die Reaktion verläuft deutlich exotherm. Der dabei entstehende
Amidin-Aluminiumchlorid-Komplex wird durch Zugabe von Wasser zersetzt.
Hinsichtlich der notwendigen Aufarbeitung, als auch in den au erzielenden
Ausbeuten unterscheiden sich die Trichloracetamidine aliphatisch- und
aromatisch-substituierter 2-Amino-1,3,4-oxadiazole deutlich voneinander. Beide
Gruppen werden jedoch stets als freie Basen isoliert.
Durch den Elektronenzug der Trichlormethylgruppe und des Oxadiazolringes ist die
Basizität der N-[5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yl]-trichloracetamidine soweit
erniedrigt, dass in wässriger Lösung keine Protonierung erfolgt.
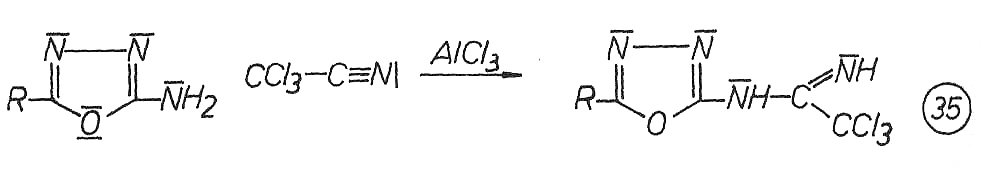
Über die Amino-Imino-Tautomerie N-monosubstituierter Trichloracetoamidine liegen eine Reihe von Arbeiten vor, die sich jedoch zum Teil in ihrer Aussage unterscheiden. Während GRIVAS und TAURINS, gestützt auf umfangreiche IR-spektroskopische Untersuchungen, das Vorliegen von substituierten Trichloracetamidinen in der Iminoform A postulieren, kommt MORITZ durch seine Untersuchungen an partiell deuterierten N-(Alkyl,aryl)-substituierten Trichloracetamidinen zu dem Schluss, dass jeweils Tautomerengemische vorliegen.
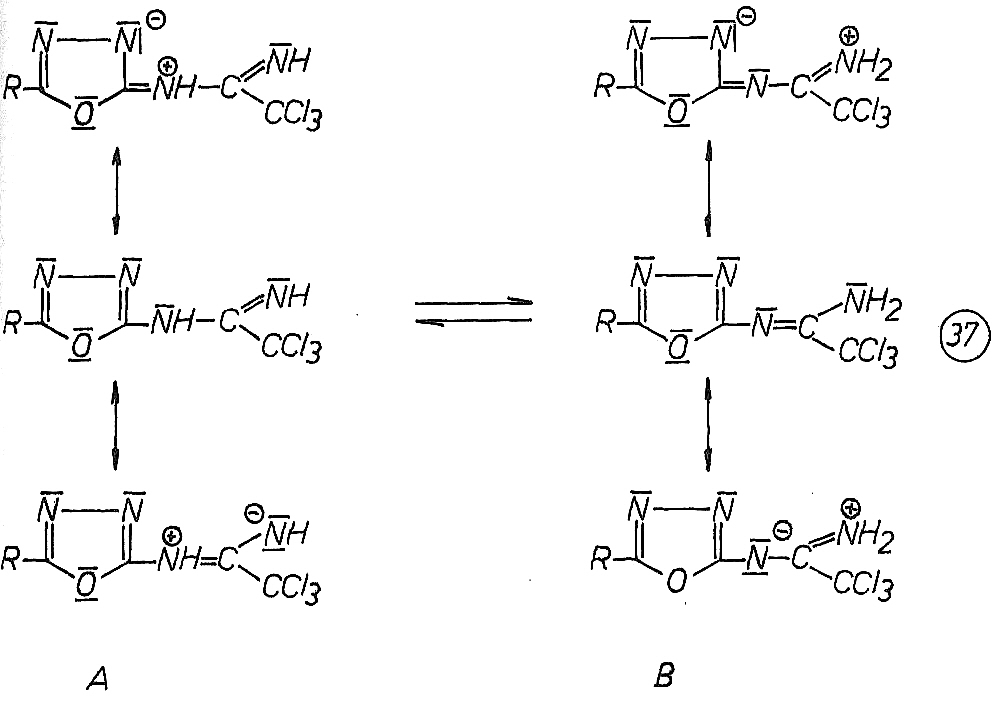
Dabei treten N-alkylsubstituierte Trichloracetamidine hauptsächlich in der Iminoform A und N-aryl-substituierte Trichloracetamidine in der Aminoforrn B auf. Als Ursache für die Begünstigung der Aminoform B bei aromatischen Amidinen wird die dadurch ermöglichte Konjugation des aromatischen Ringsystems mit der C=N-Doppelbindung der Amidingruppe diskutiert. Somit sind für die N-[5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yl]-trichloracetamidine sowohl die Imino- als auch die Aminoform möglich. Beide Tautomeren sind mesomeriestabilisiert (37).
Durch Aufnahme der 1H-NMR-Spektren konnte das Vorliegen der Trichloracetamidine VIII a – d in der Iminoform A nachgewiesen werden. Die analytischen Daten der so synthetisierten N-[5-(Alkyl,aryl)-1,3,4-oxadiazol-2-yl]-trichloracetamidine VIII sind in Tab. 12 gegeben.