zur Startseite
Dimere Imino-oxadiazoline
Im Rahmen der Untersuchung von Eigenschaften der 5-substituierten 2-Amino-1,3,4-oxadiazole sind als Ergebnis von Alkylierungen verschiedene 2-Imino-3-alkyl-1,3,4-oxadiazoline hergestellt worden. Dabei wurde ebenfalls die Bildung von Dimeren beschrieben.
"Zur Kenntnis der kernsubsituierten 2-Amino-1,3,4-oxadiazole"
Tabelle 16; Manfred Just,
Dissertation (1963) Universität Potsdam.
"Verfahren zur Herstellung von 3,5-disubstituierten 2-Imino-1,3,4-oxadiazolinen"; DDR-Wirtschaftspatent 52 668 (20.12.1966);
Gehlen, Heinz; Just, Manfred
Pellizzari beschreibt die Umsetzung von α-Cyanhydrazin mit Benzoylchlorid.
Obwohl die Eigenschaften des Pellizzari-Produktes nicht denen des 2-Imino-3-phenyl-5-methyl-1,3,4-oxadiazolins entsprechen, führt aber der angegebene Syntheseweg zum Imino-oxadiazolin. Die von ihm erhaltene hochschmelzende Verbindung, die er als Polymeres bezeichnete, ist das dimere Produkt gewesen.
G. Pellizari; G. 56, 695 (1926).
Später wurden die Zusammenhänge zwischen den Substituenten am 2-Imino-1,3,4-oxadiazolin und deren Tendenz zur Dimerisierung untersucht.
"Zur Kenntnis der 2-Imino-1,3,4-oxadiazoline", Tabellen 8 bis 23 ; Manfred Just;
Dissertation B (1976), Universität Potsdam.
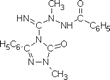 In einer weiteren Arbeit über die Eigenschaften von 2-Imino-oxadiazolinen sind gleiche Abhängigkeiten gefunden worden.
In einer weiteren Arbeit über die Eigenschaften von 2-Imino-oxadiazolinen sind gleiche Abhängigkeiten gefunden worden.
Es wurde für die Dimeren-Struktur des 2-Imino-3-methyl-5-phenyl-1,3,4-oxadiazolins ein
N'-[imino(1-methyl-5-oxo-3-phenyl-1,5-dihydro-4H-1,2,4-triazol-4-yl)methyl]-N'-methylbenzoylhydrazid vorgeschlagen.
"Reaktion von Cyansäureestern mit N- und N'-substituierten Carbonsäurehydraziden", Neitzel, M.; Zinner, G.;
Arch. Pharm. (Weinheim), 313, Seiten 867-878 (1980)
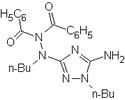 Die Struktur des Dimeren vom 2-Imino-3-n-butyl-5-phenyl-1,3,4-oxadiazolin konnte
aber als
Die Struktur des Dimeren vom 2-Imino-3-n-butyl-5-phenyl-1,3,4-oxadiazolin konnte
aber als
5-Amino-1-n-butyl-3-(N-n-butyl-N',N'-dibenzoyl-hydrazino)-1,2,4-Triazol (C24H30N6O2) erkannt werden.
"5-Amino-1-butyl-3-(N-butyl-N',N'-dibenzoyl-hydrazino)-1,2,4-Triazol",
Reck, G.; Czugler, M.; Parkanyi, L.; Sauer, E.; Cryst. Struct. Comm. 10, Seiten 565-570, (1981)
Di-aliphatisch-substituierte 2-Imino-1,3,4-oxadiazoline sind nur als Salze einige Zeit beständig. Deren Basen dimerisieren nach der Freisetzung aus ihren Salzen rasch zu den entsprechenden Triazolen.
Imino-1,3,4-oxadiazole mit je einem aliphatischen und einem aromatischen
Substituenten lassen sich beim Erwärmen dimerisieren. Als wasserhaltige
Verbindungen sind sie beständiger als scharf getrocknet. In diesem Fall erfolgt
die Dimerisierung sehr rasch (siehe Imino-oxadiazoline). Der Einfluss der Substituenten am aromatischen Ring auf die Dimerisierungs-Tendenz ist in Bezug auf Art und Stellung nicht ausgeprägt.
Di-aromatisch-substituierte Imino-1,3,4-oxadiazoline sind thermisch stabil. Bei stärkerem Erhitzen um der Schmelzpunkt zersetzen sie sich.
Die 5-Amino-3-hydrazino-1,2,4-triazole sind geringer basisch als die zugrundeliegenden Imino-oxadiazoline. Ein Substituenten-Einfluss auf die Basizizät ist nur gering.
Kinetische Untersuchungen zur Dimerisation sind von Sauer durchgeführt worden: "Zur
Kenntnis der 2-Imino-1,3,4-oxadiazoline"; Sauer, Erika; Dissertation (1980), Universität Erfurt
Von ihr wurden die 5-Bromphenyl- und 5-Iodphenyl-imino-oxadiazoline hergestellt und untersucht.
Substanzlisten
5-Amino-1-methyl-3-(Nα-methyl-Nβ,Nβ-diacyl-hydrazino)-1,2,4-triazol
5-Amino-1-äthyl-3-(Nα-äthyl-Nβ,Nβ-diacyl-hydrazino)-1,2,4-triazol
5-Amino-1-(alkyl, aryl)-3-(Nα-(alkyl, aryl)-Nβ,Nβ-diacyl-hydrazino)-1,2,4-triazol
nach oben
zur Startseite
 In einer weiteren Arbeit über die Eigenschaften von 2-Imino-oxadiazolinen sind gleiche Abhängigkeiten gefunden worden.
In einer weiteren Arbeit über die Eigenschaften von 2-Imino-oxadiazolinen sind gleiche Abhängigkeiten gefunden worden. 