"Zur Kenntnis von 5-Nitropyrimidinen" Dissertation (1977), Klaus Schmidt, Pädagogische Hochschule Erfurt/Mühlhausen
Pyrimidin-Derivate sind besonders in Bezug auf ihre pharmazeutische Wirkung untersucht worden. Trotz der Vielzahl von Veröffentlichungen und der großen Zahl synthetisierter Pyrimidine weist dieses Gebiet noch Lücken auf. So gibt es bei der Synthese von 5-Nitro-pyrimidinen durch Nitrierung mit Nitriersäuren noch Unklarheiten, die auf das Fehlen systematischer Untersuchungen zurückzuführen sind. Die in den letzten Jahren an Aromaten erfolgreich eingesetzten säurefreien Nitrierungsmittel sind bei Pyrimidin-Derivaten noch nicht erprobt und untersucht.
Die Nitrierung von Chlorpyrimidinen, speziell dem 2-Amino-4,6-dichlor-pyrimidin, ist deshalb von Bedeutung, weil sowohl die Reaktion, als auch das zu erwartende 5-Nitroderivat noch nicht bekannt sind. Das 2-Amino-4,6-dichlor-5-nitropyrimidin ist wegen der leichten Substituierbarkeit der Chloratome als Ausgangsverbindung für weitere Derivatisierungen von Interesse.
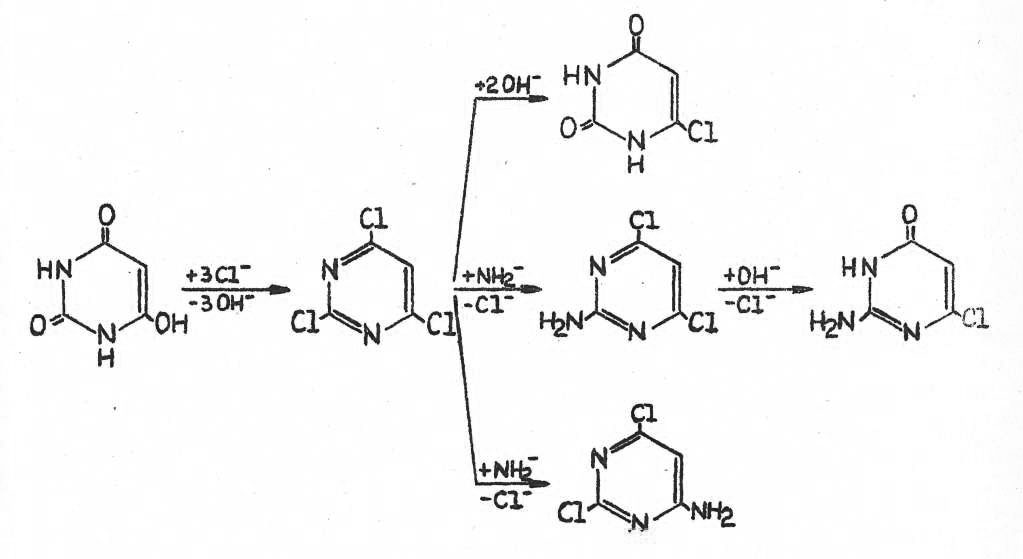
Eine zentrale Stellung besitzt das Trichlorpyrimidin, das aus Barbitursäure mit Phosphoroxychlorid und N,N-Diäthylanilin mit 97%iger Ausbeute erhalten wird. Die Umsetzung mit Laugen und Aminen führt dann mit guten Ausbeuten zu Derivaten.

Die Herstellung von Chlor-oxo-pyrimidinen aus der Trichlorverbindung ist bekannt. Durch Hydrolyse mit Natronlauge bei Rückflusstemperatur werden zwei Chloratome substituiert und das 4-Chlor-2,6-dioxo-1,3-dihydropyrimidin (XII) entsteht. Der Austausch eines Chloratoms durch eine Hydroxylgruppe ist bisher noch nicht beschrieben.
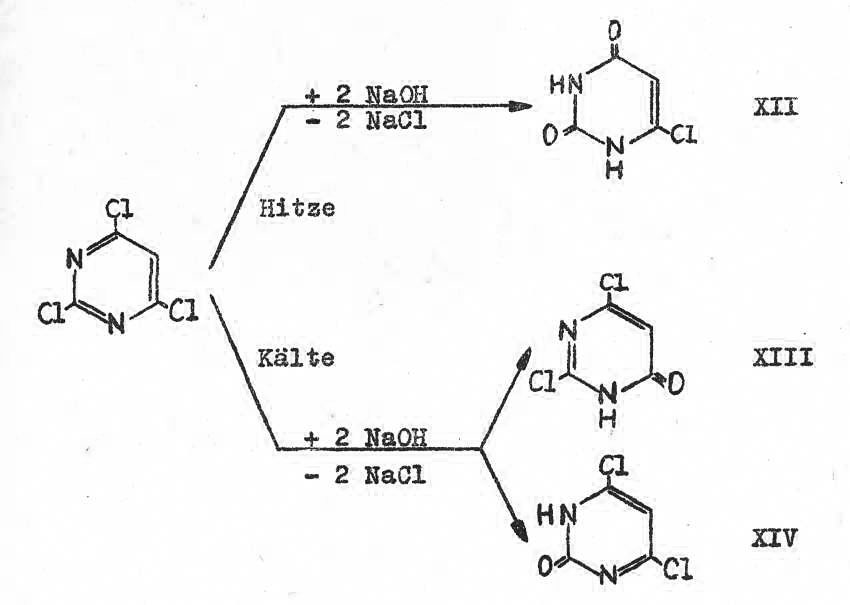
Unter milden Bedingungen werden aber bei der Hydrolyse zwei Reaktionsprodukte isoliert, die sich im Schmelzpunkt und in der Löslichkeit in Methanol unterscheiden.
Eine ist eindeutig das Dioxo-dihydro-chlorpyrimidin (XII). Über die Aminolyse und den Vergleich mit autentischen Verbindungen konnte bewiesen werden, dass als zweite Reaktionssubstanz das 4,6-Dichlor-2-oxo-1-hydropyrimidin (XIII) gebildet wurde. Die Bildung des Isomeren (XIV) konnte ausgeschlossen werden. Tabelle 5 zeigt die neuen Monooxo-pyrimidine.
Neue Pyrimidinderivate durch nucleophile Substitution
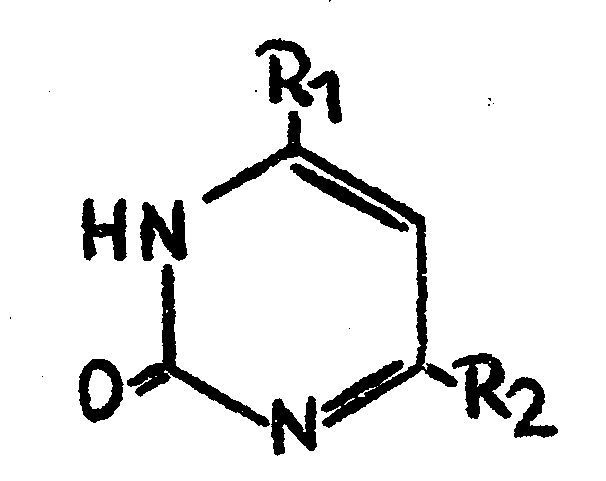
|
Nr. |
R1 |
R2 |
Summenformel Molmasse |
Fp. (°C) |
Ausbeute (%) |
Analyse C %
|
H % |
|
1 |
Cl |
Cl |
C4H2ON2Cl2 164,98 |
173-175 1) |
33,6 |
29,12 28,59 |
1,22 1,42 |
|
2 |
(CH3)2N |
(CH3)2N |
C8H14ON4 182,23 |
233-252 1) (Z) |
36,7 |
52,73 52,54 |
7,74 7,93 |
1) aus Wasser umkristallisiert
Die Nitrierung der Barbitursäure ist eine der bestuntersuchtesten Reaktionen an Pyrimidinen. Mit rauchender Salpetersäure ist die 5-Nitrobarbitursäure in 91%iger Ausbeute aus Barbitursäure herzustellen. Das analoge 4-Amino-2,6,dioxo-1,3-dihydro-pyrimidin wird unter gleichen Bedingungen zum 4-Amino-2,6-dioxo-5-nitro-1,3-dihydro-pyrimidin nitriert. Mit guten Ausbeuten sind die folgenden Verbindungen zu den entsprechenden 5-Nitro-Derivaten umsetzbar:
| -Pyrimidin | Nitriermittel |
Ausbeute (%) |
| 4-Hydroxy-2,6-dioxo-1,3-dihydro- | HNO3 |
91 |
| 2-Amino-4-hydroxy-6-oxo-1-hydro- |
HNO3 |
64 |
| 2-Amino-2,6-dioxo-1,3-dihydo- |
HNO3 |
70 |
2,4-Diamino-6-oxo-1-hydro- |
HNO3/H2SO4 |
99 |
4,6-Diamino-2-oxo-1-hydro- |
HNO3/H2SO4 |
77 |
| 2-Amino-4-chlor-6-oxo-1-hydro- |
HNO3/H2SO4 |
74 |
2,4,6-Triamino- |
HNO3/H2SO4 |
63 |
2-Amino-4,6-dichlor- |
HNO3/H2SO4 |
52 |
| 4-Chlor-2,5-dioxo-1,3-dihydro- |
HNO3/H2SO4 |
31 |
Anmerkung: rauchende Salpetersäure und konzentrierte Schwefelsäure
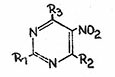
|
Nr. |
R1 |
R2 |
R3 |
Summenformel
Molmasse |
Fp (°C) |
Ausbeute |
Analyse ber. |
||||
|
3 |
OH |
NH2 |
NH2 |
C4H5O3N5 171,11 |
350 |
79,5 1) |
28,02 28,37 |
2,92 2,99 |
|||
|
4 |
NH2 |
NH2 |
OH |
C4H5O3N5 171,11 |
350 |
99,4 |
28,07 27,71 |
2,92 2,81 |
|||
|
5 |
NH2 |
Cl |
Cl |
C4H2O2N3Cl2 208,99 208,15 |
106-108 2)(Z) 108-110 3)(Z) |
49,8 2) 51,8 3) |
23,01 22,69 2) 23,29 3) |
0,95 0,82 2) 0,91 3) |
|||
1) mit
Wasser-Äthanol-Dioxan gewaschen
2) aus Äthanol/Wasser 1:3
umkristallisiert
3) aus Hexan umkristallisiert
Mit dem BF3.N2O4-Komlex ist nur die Barbitursäure mit guten Ausbeuten nitrierbar.
Der BF3.N2O5-Komplex bietet dagegen wesentliche Vorteile, denn damit ist es erstmals gelungen das 4-Amino-2,6-dichlor-5-nitropyrimidin herzustellen. (siehe Synthesevorschrift 1)
Die folgende Tabelle zeigt die Abhängigkeit der Ausbeuten von den verschiedenen Nitriermitteln:

| Ausgangsverbdg. | Ausbeute (%) bei Nitrierung mit | |||||
| R1 | R2 |
R3 | HNO31) | HNO31) / H2SO42) | BF3.N2O4 | BF3.N2O5 |
| OH | OH | OH | 91,2 | -- 3) | 75,5 | 93,6 |
| OH | NH2 | OH | 49,8 | 824) | - |
70,2 |
| NH2 | NH2 | NH2 | 40,7 | 63,4 | - | 53,8 |
| NH2 | Cl | Cl | - | 51,8 | - | 20,6 |
| Cl |
NH2 |
Cl | - | - | - |
10,5 |
| 1) rauchend 2) konzentriert 3) nicht untersucht 4) konzentrierte HNO3/konzentrierte H2SO4 |
||||||