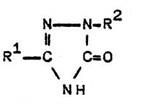
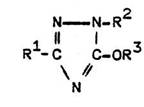
 1,3-Disubstituierte 5-Alkoxy-1,2,4-triazole aus
1,3-Disubstituierte 5-Alkoxy-1,2,4-triazole aus
3,5-disubstituierten 2-Imino-1,3,4-oxadiazolinen
| Nr. |
R1 |
R2 |
R3 |
Summenforlmel |
Analyse (ber.:/gef.:) |
Schmelzp. |
IR (KBr): cm-1 |
Rkt.- |
Ausb. |
|
| 1 | Carboxyäthyl |
Phenyl |
Äthyl |
C13H15N3O3 |
59,76 |
5,79 |
64-65 | 1730 sst (C=O) |
1
|
40
|
| 2 | p-Chlorphenyl |
Phenyl |
Methyl |
C15H12ClN3O |
63,05 |
4,23 |
81-84 | 1560 sst |
4
|
45
|
| 3 | m-Chlorphenyl |
Phenyl |
Methyl |
C15H12ClN3O |
63,05 |
4,23 |
76-77 | 1560 sst |
4
|
47
|
| 4 | o-Chlorphenyl |
Phenyl |
Methyl |
C15H12ClN3O |
63,05 |
4,23 |
95-96 | 1560 sst |
4
|
46
|
| 5 | p-Carbomethoxy- |
Phenyl |
Methyl |
C17H15N3O3 |
66,01 |
4,89 |
136-141 | 1720 sst (C=O) |
8
|
89
|
| 6 | p-Carbomethoxy- |
Phenyl |
i-Butyl |
C20H21N3O3 |
68,36 |
6,02 |
98-114 | 1720 sst (C=O) |
20
|
77
|
| 7 | p-Carbomethoxy- |
Phenyl |
Benzyl |
C23H19N3O3 |
71,67 |
4,97 |
115-122 | 1715 sst (C=O) |
8
|
48
|
| 8 | p-Nitrophenyl |
Phenyl |
Methyl |
C15H12N4O3 |
60,81 |
4,08 |
158-162 | 1510 st (NO2)as |
13
|
36
|
| 9 | p-Nitrophenyl |
Methyl |
Methyl |
C10H10N4O3 |
51,28 |
4,30 |
Subl. 135 | 1565 sst |
3,5
|
27
|
| 10 | p-Nitrophenyl |
Methyl |
i-Butyl |
C13H16N4O3 |
56,51 |
5,84 |
101-102 | 1565 sst |
3
|
68
|
| 11 | p-Nitrophenyl |
Methyl |
Cyclohexyl |
C15H18N4O3 |
59,59 |
6,00 |
132-135 | 1550 sst |
2
|
61
|
| 12 | m-Nitrophenyl |
Methyl |
Methyl |
C10H10N4O3 |
51,28 |
4,30 |
102-105 | 1570 st |
7
|
46
|
Zeichenerklärung: sst = sehr stark; st = stark; m = mittel; Subl. = Sublimieren ab
Interessante analoge Alkoxy-triazole mit Carbonsäureester-Substituenten beschreibt Bode : (siehe Tabelle)