Die 2-Trichloracetylamino-1,3,4-oxadiazole sind, abhängig von der Art des Substituenten, hydrolyseempfindlich. Während bei alkylsubstituierten Vertretern schon durch Feuchtigkeitsspuren Hydrolyse zu den entsprechenden Trichloracetaten eintritt, sind die aromatischsubstituierten Verbindungen nahezu hydrolyseunempfindlich.
So zeigt das 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol auch nach einstündigem Kochen in verdünnter Salzsäure keine Veränderung, während die gleiche Behandlung mit verdünnter Natronlauge zu völliger Ringumlagerung führt.
2-Trichloracetylamino-1,3,4-oxadiazole sind ebenso wie die 2-Acylamino-1 ,3,4-oxadiazole in Wasser schlechter löslich als die Ausgangsverbindungen, wobei die kurzkettig aliphatisch substituierten Vertreter noch gut wasserlöslich bleiben. Sie lösen sich in verdünnten Säuren nicht besser als in Wasser.
Analog den
2-Acetylamino-5-aryl-1,3,4-oxadiazolen bilden auch die
5-Aryl-2-trichloracetylamino-1,3,4-oxadiazole Alkaliverbindungen.
Im Unterschied zu der Bildung von Alkaliverbindungen der 2-Acetylamino-5-aryl-1,3,4-oxadiazole durch Behandeln mit alkoholischer Natriumalkoholatlösung, können die Alkaliverbindungen der aminogruppentrichloracetylierten 1,3,4-Oxadiazole im wässrigen Milieu durch Kochen mit Alkalicarbonat
oder -hydrogencarbonat gewonnen werden. Während die Natriumsalze der 2-Acetylamino-1,3,4-oxadiazole in wässriger Lösung zerfallen, sind die Natrium- bzw. Kaliumsalze der
5-Aryl-2-trichloracetylamino-1,3,4-oxadiazole in Wasser beständig.
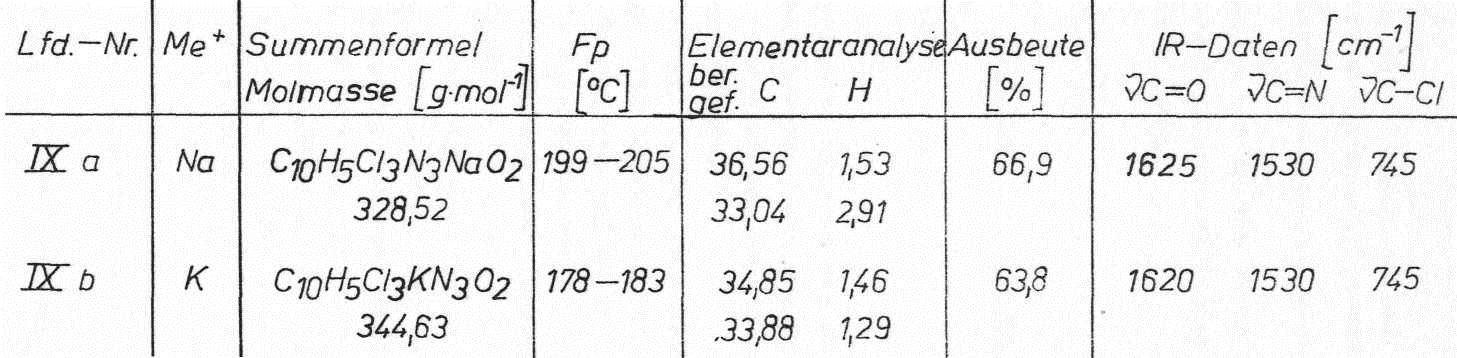
Die Natrium- und Kaliumsalze der 2-Trichloracetylamino-1,3,4-oxadazole sind in heißem Wasser sehr gut löslich. Während die Natriumsalze beim Abkühlen als lange Fäden kristallisieren, können die Kaliumsalze erst durch Einengen im Vakuum isoliert werden.
Die so erhaltenen Alkalisalze können gegebenenfalls durch überschüssiges Alkalicarbonat verunreinigt sein. Für Folgeumsetzungen sind diese geringen anorganischen Beimengungen ohne Belang, so dass auf eine Reinigung verzichtet werden konnte. Erwartungsgemäß zeigen die IR-Spektren der Natrium- bzw. Kaliumsalze keine NH-Valenzabsorptionen mehr.

Die Reaktion der Alkalisalze mit Benzylbromid führt ausschließlich zu den am Ring substituierten Verbindungen. Aus dem Natriumsalz des 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol bildet sich das 3-Benzyl-5-phenyl-2-trichloracetylimino-1,3,4-oxadiazol (Seite: Umsetzung von 3-(Aryl,alkyl)-5-aryl-2-imino-1,3,4-oxadiazolinen mit Trichloracetylchlorid, Substanz: Xa)
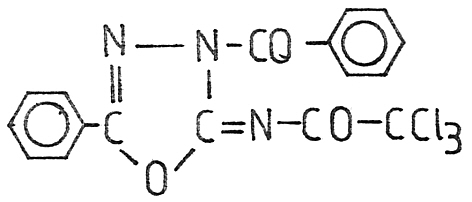 Bei der Behandlung des Natriumsalzes von 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol mit Benzoylchlorid entsteht in Analogie zur Umsetzung mit Benzylbromid das
3-Benzoyl-5-phenyl-2-trichloracetylimino-1,3,4-oxadiazolin X b. Das Reaktionsprodukt ist zunächst noch durch 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol verunreinigt (vermutlich durch Feuchtigkeit hydrolysiert). Daraus wird durch Extraktion mit Diethylether die Zielverbindung isoliert. Die analytischen Daten der Verbindung sind in Tab. 5 gegeben (Seite:
Umsetzung von 3-(Aryl,alkyl)-5-aryl-2-imino-1,3,4-oxadiazolinen mit Trichloracetylchlorid,
Substanz: Xb)
Bei der Behandlung des Natriumsalzes von 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol mit Benzoylchlorid entsteht in Analogie zur Umsetzung mit Benzylbromid das
3-Benzoyl-5-phenyl-2-trichloracetylimino-1,3,4-oxadiazolin X b. Das Reaktionsprodukt ist zunächst noch durch 5-Phenyl-2-trichloracetylamino-1,3,4-oxadiazol verunreinigt (vermutlich durch Feuchtigkeit hydrolysiert). Daraus wird durch Extraktion mit Diethylether die Zielverbindung isoliert. Die analytischen Daten der Verbindung sind in Tab. 5 gegeben (Seite:
Umsetzung von 3-(Aryl,alkyl)-5-aryl-2-imino-1,3,4-oxadiazolinen mit Trichloracetylchlorid,
Substanz: Xb)
Die Umsetzungen der Alkaliverbindungen mit Dimethylsulfat, Diethylsulfat und Trichloracetylchlorid verliefen ergebnislos. Die Alkalisalze wurden unverändert zurückerhalten. Die Reaktion des Natriumsalzes mit Cyanurchlorid liefert ein Reaktionsprodukt, das nicht eindeutig charakterisiert werden konnte und außerdem in nur geringem Maße anfällt.