zur Themenseite
zur Startseite
Reaktion mit Carbonylverbindungen
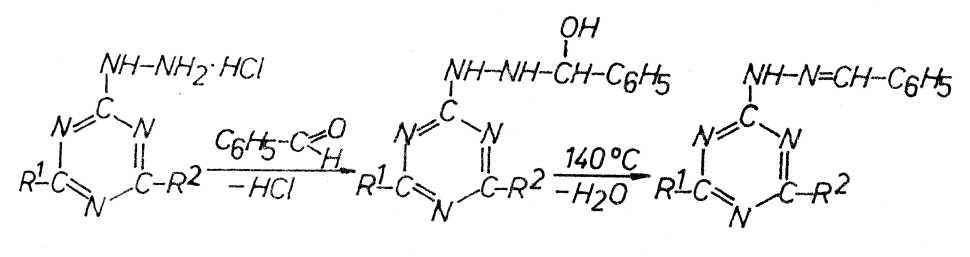
Die Umsetzung von Hydrazinen mit Carbonylverbindungen ist vielfältig
beschrieben. Hydrazino-triazine reagieren entsprechend. Bei der Reaktion konnte
in zwei Fällen das Additionsprodukt isoliert werden. Der Eliminierungsschritt
wurde erst bei Temperaturen über 140 °C erzwungen.
Umsetzungen der Hydrazino-triazin-Basen mit Carbonylverbindungen blieben zum
Teil ohne Erfolg. Die Analysen der Reaktionsprodukte ergaben einerseits die
Ausgangsstoffe, andererseits aber auch Hydrolyse- und Polymerprodukte.
Nur mit der aus dem Hydrochlorid frisch hergestellten Base gelang die
Kondensation mit Carbonylverbindungen. Zu hohe Temperaturen bewirken haben ein
Abspalten von Phenoxygruppen. Ursache ist die deutlich höhere Unbeständigkeit
der Aryloxy-hydrazino-s-triazine gegenüber den entsprechenden Hydrochloriden.
Die Kondensationsreaktion von Hydrazino-s-triazinen mit Zuckern gelang nicht.
Trotz breiter Variationen der Reaktionsbedingungen, von Temperatur, Zeit und
Lösungsmittel konnte kein befriedigendes Resultat erzielt werden. Sie eignen
sich nicht als Fäl1ungsreagenz für Zucker.
Dagegen ist der Einsatz der monohydrazinsubstituierten Aryloxy-s-triazine als
Carbonylreagenz durchaus gegeben. Die analytischen Daten der präparierten
Verbindungen sind den folgenden Tabellen zu entnehmen.
2,4-Diaryloxy-6-(Nβ-benzalhydrazino)-s-triazine
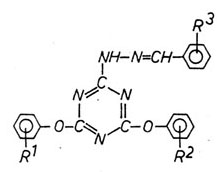
|
Nr.
|
R1
= R2
|
R3
|
Summenformel Molmasse
|
Fp. (°C)
|
Ausb.
%
|
Analyse
C %
H %
|
|
1
|
-o-CH3
|
-o-OH
|
C24H21N5O3
411,44
|
210-213
|
66
|
67,43 67,80
|
4,95 5,01
|
|
2
|
-o-CH3
|
- p-NO2
|
C24H20N6O4
456,44
|
260-263
|
55
|
63,15 62,95
|
4,41 4,80
|
|
3
|
-p-CH3
|
-H
|
C24H21N5O2
395,44
|
194-197
|
78
|
70,07 69,49
|
5,10 5,18
|
|
4
|
-p-CH3
|
-p-OCH3
|
C25H23N5O3
441,47
|
190-194
|
72
|
68,17 68,78
|
5,03 5,16
|
|
5
|
-m-NO2
|
-H
|
C22H15N7O6
473,38
|
223 Z.
|
70
|
55,82 55,61
|
3,19 3,09
|
|
6
|
-p-NO2
|
-H
|
C22H15N7O6
473,38
|
235-238
|
65
|
55,82 56,73
|
3,19 4,09
|
|
7
|
-p-NO2
|
-p-OCH3
|
C23H17N7O7
503,41
|
240 Z.
|
53
|
54,88 54,60
|
3,41 3,56
|
|
8
|
-2,4-Cl
|
-H
|
C22H15Cl4N5O2
523,17
|
260-263
|
44
|
50,50 49,96
|
2,89 2,44
|
|
9
|
-2,4-Cl
|
-o-OH
|
C22H15Cl4N5O3
539,17
|
179-185
|
46
|
49,00 50,46
|
2,08 3,09
|
|
10
|
-2,4,5-CI
|
-H
|
C22H11Cl6N5O2
590,04
|
266-270
|
32
|
44,78 43,79
|
1,88 1,46
|
2,4-Dinaphthoxy-6-(Nβ
-benzalhydrazino)-s-triazine
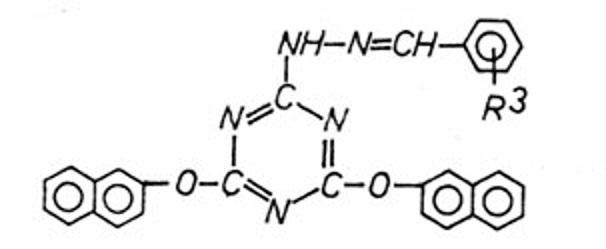
|
Nr.
|
R3
|
Summenformel Molmasse
|
Fp. [°C]
|
Ausb.
[%]
|
C
%
|
H %
|
|
11
|
-H
|
C30H21N5O2
483,50
|
179- 182
|
65
|
74,52 71,92
|
4,37 3,92
|
|
12
|
-o-OH
|
C30H21N5O3
499,50
|
225- 228
|
72
|
72,13 72,00
|
4,23 3,99
|
|
13
|
-p-NO2
|
C30H20N6O4
528,49
|
255- 257
|
56
|
68,17 65,12
|
3,81 3,60
|
|
14
|
-p-OCH3
|
C31H23N5O3
513,52
|
242- 245
|
61
|
72,50 72,20
|
4,51 4,66
|
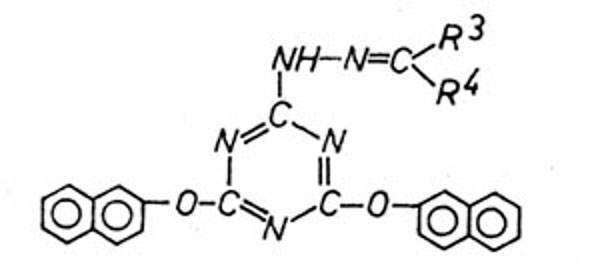
|
|
R3
|
R4
|
|
|
|
|
|
|
15
|
-CH3
|
-CH3
|
C26H21N5O2
435,46
|
275- 278
|
62
|
71,70 70,52
|
4,86 4,71
|
|
Ausbeute
bezogen auf 2,4-Diaryloxy-6-hydrazino-s-triazin-hydrochlorid
|
2-Aryloxy-4,6-di-(N
β-benzalhydrazino)-s-triazine
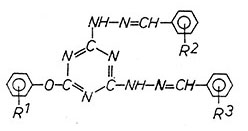
|
Nr
|
R1
|
R2
= R3
|
Summenformel Molmasse
|
Fp. (°C)
|
Ausbeute
%
|
Analyse
ber.
C %
H %
gef.
|
|
1
|
-H
|
-H
|
C23H19N7O 409,43
|
254-258
|
78
|
67,47 65,30
|
4,68
4,20
|
|
2
|
-H
|
-o-OH
|
C23H19N7O2
425,43
|
130-135
|
79
|
64,93 64,50
|
4,50
4,23
|
|
3
|
-H
|
-p-N(CH3)2
|
C27H29N9O 495,56
|
203-207
|
62
|
65,43 64,86
|
5,89
4,92
|
|
4
|
-o-NO2
|
-o-OH
|
C23N18N8O5
486,42
|
205-210
|
79
|
56,78 56,63
|
3,73
3,57
|
|
5
|
-m-CH3
|
-o-OH
|
C24H21N7O3
455,45
|
207- 213
|
63
|
63,27
64,21
|
4,65 4,68
|
|
6
|
-p-NO2
|
-H
|
C23N18N8O3
454,43
|
82-100 Z.
|
65
|
60,78 62,71
|
3,99 5,02
|
|
7
|
2,4-NO2
|
-H
|
C23H17N9O5
499,42
|
258- 281
|
70
|
55,31 53,76
|
3,43
3,57
|
|
8
|
2,4-NO2
|
-o-OH
|
C23H17N9O7
531,42
|
293- 295
|
74
|
51,98 50,42
|
3,22
3,10
|
|
9
|
2,4-CI
|
-o-OH
|
C23H17CI2N7O3
519,31
|
205- 210
|
76
|
54,13 53,92
|
3,36
3,12
|
|
10
|
2,4,5-Cl
|
-o-OH
|
C23H16CI3N7O3
544,75
|
191- 194
|
76
|
50,71 49,86
|
2,96
2,73
|
|
11
|
-o-OCH3
|
-H
|
C24H21N7O4
471,45
|
165- 169
|
80
|
61,44 60,12
|
4,49
4,16
|
<|
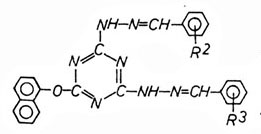
2-Naphthoxy-4,6-di-(N
β-benzalhydrazino)-s-triazin
|
|
12
|
|
-o-OH
|
C27H21N7O3
491,51
|
165- 178
|
82
|
65,98 64,78
|
4,27
4,05
|
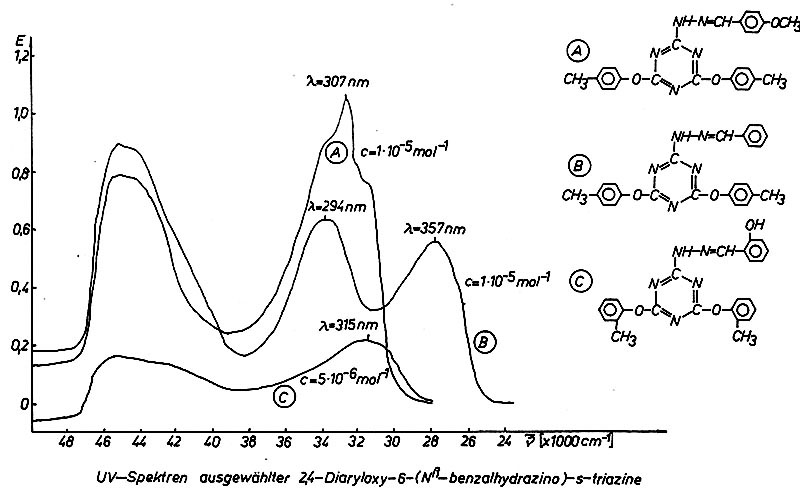
Ein Einsatz der synthetisierten Triazinylhydrazone als UV-Filtersubstanzen
liegt durchaus im Bereich des Möglichen. An UV-Lichtschutzfilter wird unter
anderem die Anforderung gestellt, Strahlung im UVA-Bereich (315-400 nm) und im
UVB (280-315 nm) selektiv, mit möglichst hoher Absorption zu filtern. Das
Diagramm zeigt die Absorption einiger Triazinylhydrazone.
nach oben
Reaktion mit Acylierungsmitteln
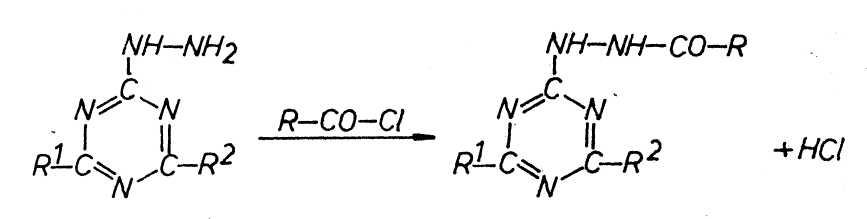
Bei der Wahl der Synthesewege zur Herstellung von
2-(N-acylhydrazino)-4,6-diaryloxy-s-triazine gibt es zwei Möglichkeiten, die
beide vom Cyanurchlorid ausgehen:
Die Reaktion des Cyanurchlorids mit Carbonsäure-hydraziden, beschrieben von
BEECH, BÖSENBERG,
DOVLATJAN und CHACATRJAN sowie SCHMELZER und DEGENER.
Die Acylierung von Hydrazino-s-triazinen von DOVLATJAN und
CHACATRJAN ist nur am
2-Chlor-4-(N-ethanoylhydrazino)-6-dimethylamino-s-triazins beschrieben.
Einen völlig anderen Zugang zu dieser Verbindungsklasse zeigt
GOLDHAHN bei der Reaktion
von 2-Imino-1,3,4-oxadiazolinen mit Cyansäureestern, die über
Ringspaltungsprozesse und anschließender Recylisierung abläuft.
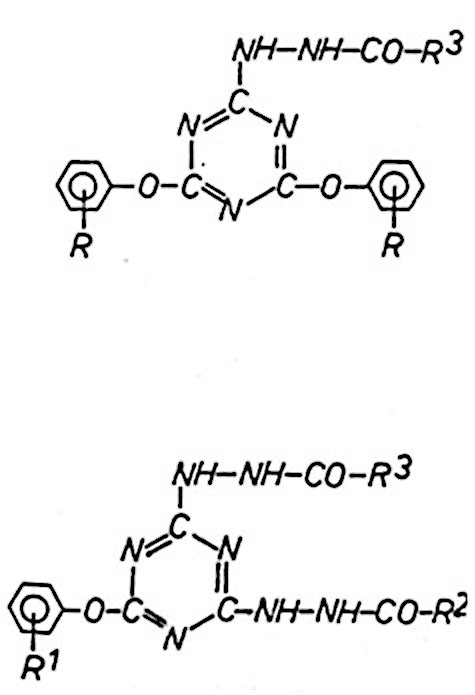
Als Acylierungsmittel kommen zwar Säurechloride, Carbonsäureanhydride,
Carbonsäuren, Ester oder Säureamide in Frage, aber nur mit Carbonsäurechloríden
wurden akzeptable Umsätze erhalten.
In Abhängigkeit von der Wahl des Acylierungsmittels sind die
Reaktionsbedingungen immer wieder neu festzulegen. Säurechloride reagieren
bereits bei Zimmertemperatur mit den in Tabelle aufgeführten
Hydrazino-s-triazinen, während die Reaktion mit dem Chlorameisensäurepropylester
bei höheren Temperaturen abläuft.
2,4-Diaryloxy-6-acylhyrazino-s-triazin
|
Nr.
|
R1
= R2
|
R3
|
Summenformel Molmasse
|
Fp [°C]
|
Ausb. [%]
|
Analyse
C % H %
|
|
1
|
-o-CH3
|
-C3H7
|
C27H23N5O3
393,43
|
267- 270
|
45
|
64,10 65,80
|
5,89 5,11
|
|
2
|
-p-Cl
|
-C3H7
|
C19H17C2N5O3
434,26
|
|
40
|
52,35 50,96
|
3,95 3,72
|
|
3
|
-β-Naphthoxy
|
-C6H5
|
C27H21N5O3
463,47
|
278- 280
|
55
|
69,96 69,75
|
4,56 4,32
|
2-Aryloxy-4,6-diacylhydrazino-s-triazin
|
Nr.
|
R1
|
R2 =
R3
|
Summenformel Molmasse
|
Fp [°C]
|
Ausb. [%]
|
Analyse
C % H %
|
|
1
|
-m-CH3
|
-C6H4-NO2 (p)
|
C24H20N8O5
500,45
|
232- 236
|
46
|
57,60 57,00
|
4,03 3,76
|
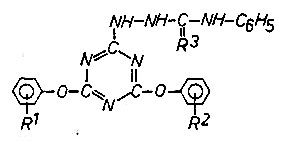
Reaktion mit Isocyanaten und Isothiocyanaten
Das Diamino-triazinyl-semicarbazid wurde 1942 von D`Alelio
hergestellt
(US-Pat.2295564, US-Pat. 2295565). Aryloxy-hydrazino-triazinyl-semicarbazide
wurden noch nicht beschrieben. Wie erwartet, erfolgen aber die Umsetzungen mit Isocyanat und Isothiocyanat in Essigsäureethylester problemlos.
Triazinylsubstituiertes Phenylsemicarbazid
(R3
= O) und Phenylthiosemicarbazid (R3
= S)
|
Nr. |
R1
= R2 |
R3 |
Summenformel |
Fp.: (°C) |
Ausbeute |
Analyse |
|
Molmasse |
(%) |
|
C % |
H % |
S % |
|
1 |
-CH3 |
-O |
C24H22N6O3
442,48 |
216 |
60 |
ber.: gef.: |
65,14
64,90 |
5,01
4,81 |
|
| 2 |
-CH3 |
-S |
C24H22N6O2S
458,52 |
240 - 243 |
45 |
ber.: gef.: |
62,86
61,20 |
4,84
4,30 |
6,99
6,10 |
zur Themenseite
zur Startseite
nach oben









