"Synthese, Reaktionsverhalten und Analytik der 1,2,4,5-Tetrazine" Frank Thalmann , Dissertation 1991, Universität Halle
"Verfahren zur Herstellung von 3-substituierten 6-Alkoxy-1,2,4,5-tetrazinen",
DDR-Wirtschaftspatent C07D 295 837 (1990); Just, Manfred; Thalmann, Frank
Thalmannuntersuchte Strategien zur Synthese von Derivaten der 1,2,4,5-Tetrazine und gibt eine umfangreiche Literaturübersicht zu Synthesen und Reaktionen von 1,2,4,5-Tetrazinen. Am Beispiel der Herstellung des Bis-(3-sulfanyl-6-phenyl-l,2,4,5-tetrazin) [3,3'-Dithio-di-(6-phenyl-l,2,4,5-tetrazin)] zeigte er, dass bekannte Methoden oft schwer reproduzierbar und lückenhaft sind. Weitere Nachnutzer dieses Verfahrens verzichteten in ihren Publikationen auf Ausbeuteangaben. [Ershov, Poskovskii: SU-Patent 390093 (1973); C.A. 79 126532z; Postovskii u.a. : Chim. Geterotsikl. Soedin (1977/11) 1564; C.A. 88, 89632v] .
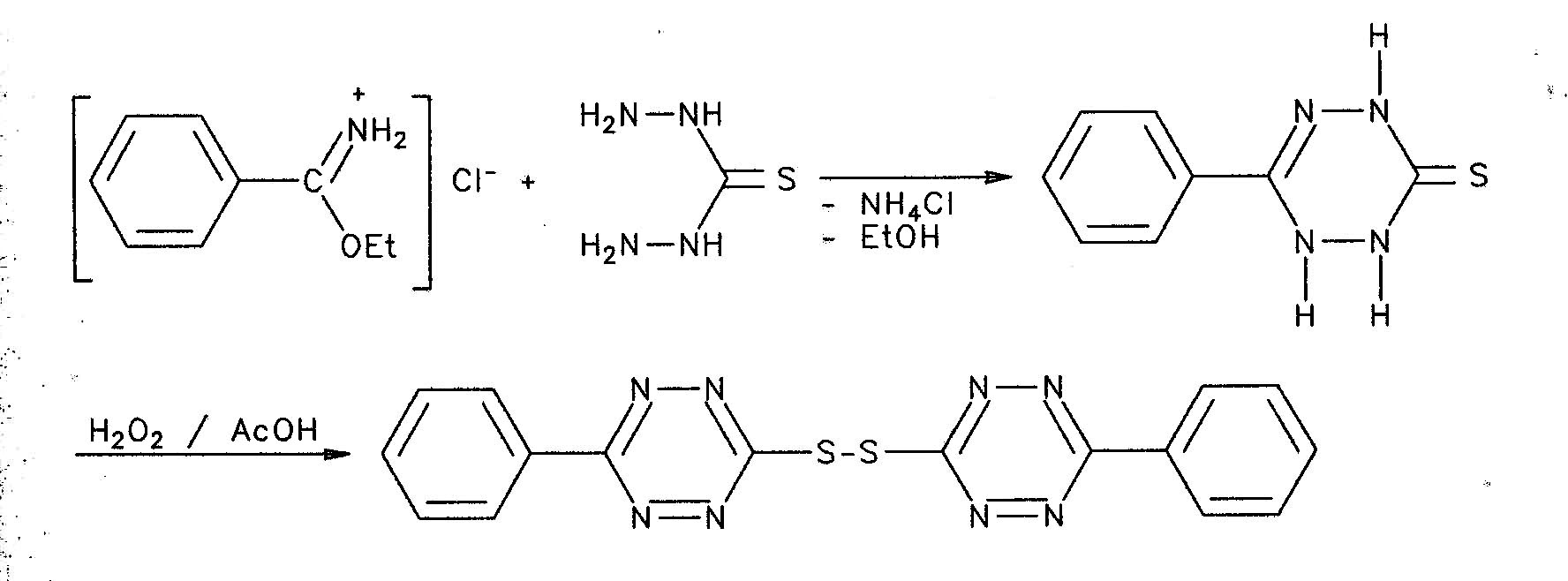
Das hierbei erhaltene gelbe Zwischenprodukt war nicht zum beschriebenen Reaktionsprodukt oxydierbar. Vielmehr blieben im IR-Spektrum die vorhandenen N-H-Valenzschwingungen trotz einer Orangefärbung des Oxidationsproduktes bestehen. Das ließ darauf schließen, dass das gewünschte 3,3'-Dithio-di-(6-phenyl-l,2,4,5-tetrazin) im günstigsten Falle nur in Spuren vorhanden sein konnte. Umfangreiche Optimierungen der Reaktionsparameter führten dann zu einer gut reproduzierbaren Vorschrift 1.
Die nach diesen Abwandlungen der Original-Vorschrift erhaltenen Gesamtausbeuten an 3,3'-Dithio-di-(6-phenyl-l,2,4,5-tetrazin) lagen bezogen auf Thiocarbohydrazid bei 32 % . Mit diesem Verfahren einschließlich der erarbeiteten Optimierungsvarianten verfügt man über die Möglichkeit der Synthese von mercaptosubstituierten 1,2,4,5-Tetrazinen, die ihrerseits den Weg zu einer großen Breite von weiteren Substituenten eröffnen. Die erreichbare Gesamtausbeute liegt in der gleichen Größenordnung wie bekannte, vergleichbare Verfahren, wobei die hier benötigten Ausgangsstoffe gut verfügbar sind.
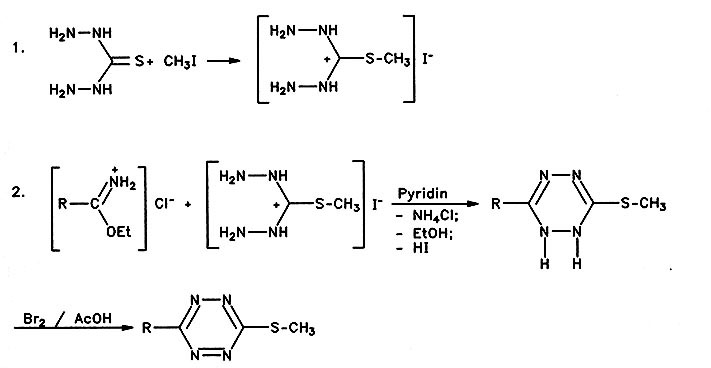
Es wurde ein sehr eleganter Weg zur Herstellung von 6-Alkylthio-tetrazinen gefunden. Damit konnten die 3-Alkyl- aber auch die 3-Aryl-Derivate in guten Ausbeuten gewonnen werden. Als Alkylierungsmittel sind mit gleichen Ausbeuten auch die Alkylbromide oder Alkylsulfate einsetzbar (Vorschrift 2).

|
R |
Ausb. (%) |
Fp. (°C) |
IR(cm-1) |
|
|
|
vis (nm/Ext.) |
|
|
Phenyl |
72 |
106 |
1350 |
1 195 |
— |
555 |
346/3,14 |
530/2,70 |
|
p-Tolyl |
82 |
118-120 |
1350 |
1190 |
_ |
560 |
356/3,07 |
532/2,67 |
|
Ethyl |
63 |
ölig |
1360 |
1090 |
1020 |
800 |
365/2,78 |
530/2,54 |
|
Benzyl |
67 |
ölig |
1360 |
1090 |
1020 |
790 |
364/2,41 |
530/2,45 |
"Verfahren zur Herstellung von 3-substituierten
6-Alkyltoxy-1,2,4,5-tetrazinen";
DDR-WP, WPC 07D 295837 (1991);
Just, Manfred; Thalmann, Frank
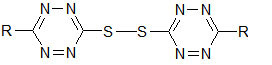
Bei der Erfindung werden auf der Basis leicht zugängiger Ausgangsverbindungen die Titelverbindungen nach einem ökonomisch günstigen Verfahren hergestellt. Dabei ist eine breite Substituentenvariation am Ringatom 6 und der Arylgruppen möglich.
Die nach dem oben beschriebenen Verfahren leicht zugängigen Bis-tetrazinyl-disulfide werden mit wasserfreien Alkoholen in Gegenwart von tertiären Aminen umgesetzt. (Vorschrift 3)
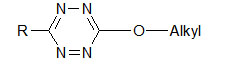
Es
können die 3- substituierten 6-Alkyloxy-1,2,4,5-tetrazine in guten Ausbeuten
isoliert werden.
Tabelle: 6-Alkoxy-3-phenyl-1,2,4,5-tetrazine
|
Alkyl |
Ausb. (%) |
Fp.(°C) |
IR(cm-1 ) |
|||||
|
Methyl |
89 |
85-87 |
1485 |
1380 |
1000 |
755 |
690 |
585 |
|
Ethyl |
91 |
101-102 |
1480 |
1350 |
1010 |
755 |
690 |
590 |
|
i-Propyl |
82 |
95-96 |
1470 |
1410 |
930 |
755 |
690 |
590 |
|
t-Butyl |
72 |
160-162 |
1420 |
1340 |
890 |
760 |
690 |
560 |
|
Cyclohexyl |
85 |
93-94 |
1470 |
1415 |
1010 |
770 |
690 |
590 |
|
Benzyl |
69 |
107-108 |
1485 |
1420 |
980 |
745 |
690 |
590
|